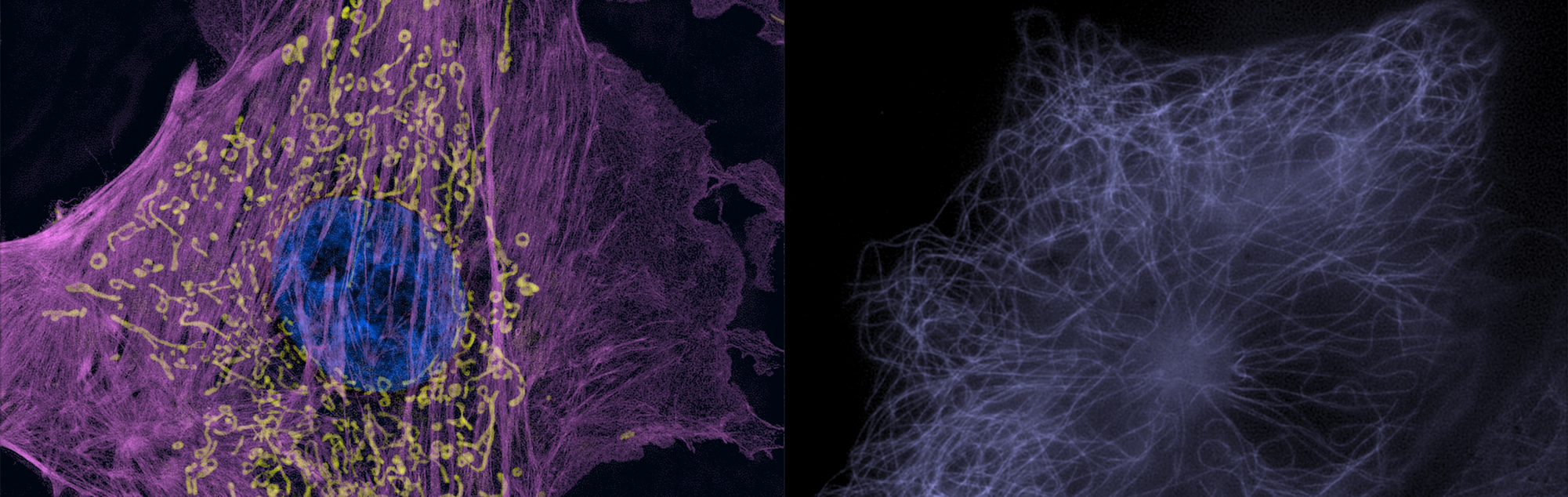
※以下に掲載している顕微鏡画像や動画の無断使用は、禁止いたします。
光学顕微鏡の限界を超えて。
光学顕微鏡では、光が「波の性質」を持つことによる、約200nmという(光学的)分解能の限界があります。そのためこれ以上は、どれだけレンズをたくさん挿入しても、またはズームで拡大しても、詳細な構造を見ることはできません。
※ただし200nm以下の物体でも、暗い中で明るく光っていれば見ることは可能です(遥か遠方の星も、夜空では見えることをイメージしてください)。「分解能」は、「見ることができる最小の物体のサイズ」ではなく、「2つの物体を分けて見ることができる限界」になります。そのため分子1個は数ナノ程度のサイズであっても、顕微鏡やカメラなどの性能が大幅に向上する以前より、「1分子観察で分子1個を観る」ことが可能でしたが、このためには励起光が届く領域を大きく制限するため、全反射蛍光光学系(TIRF)とすることが必須でした。
分解能に関して、更に詳細を知りたいならば、[Optical Microscopy Primer: Numerical Aperture and Resolution](Fig.3など)や、[Nikon: The Diffraction Barrier in Optical Microscopy]などを参照ください。どちらも英語ですが、分解能の定義や対物レンズのことも詳細に記してあるため、参考になります。
一方で各種の電子顕微鏡(SEM, TEMなど)は、光学顕微鏡よりずっと高分解能で、ナノレベルでの構造観察も可能です。ただし真空下で電子線を照射する方法上、生きた細胞サンプルには使えず、”ある瞬間を固定したサンプルの様子”となってしまいます。このため生きている細胞の内部で起こる生物現象を、リアルタイムに観察することはできません。また電子顕微鏡で優れた画像を取得するには、サンプル作成や観察には熟練したテクニックを要し、研究者が「思いついたときに、簡単に」画像を取る手法とは言いにくいです。
そのため近年になって各顕微鏡メーカーでは、”光の当て方”を工夫することで、更なる分解能で観察を行う「超解像顕微鏡」の開発を行っており、平成26年のノーベル化学賞の受賞もあって、非常に大きな注目を集めております。
ニコンの超解像顕微鏡:N-SIMに関して
構造化照明型超解像顕微鏡:N-SIMの概略
ニコンでは独自の「構造化照明」による観察法を開発し、これにより空間分解能を従来の光学顕微鏡の約2倍(約120nm)程度に向上させ、生細胞内の微細構造の可視化を実現した超解像顕微鏡システム「N-SIM」を発売しております。他の超解像観察法では更に分解能が高い手法もありますが、このN-SIMは比較的高速で画像取得が可能で、光ダメージが弱いという特長から、タイムラプス観察に向いています。当センターのN-SIMには、405/488/561/640の4本のレーザーが搭載されており、これに対応するスタンダードなBlue, Green, Red, Deep-Redの蛍光なら観察が可能であるというのも、大きな長所です。またZ方向分解能についても、一般の光学顕微鏡の限界の500nmから、約300nmまで高めることが可能で、Z方向に一層明瞭な画像が撮れるようになります。
N-SIMは販売開始から間もないうちに、雑誌「The Scientist」誌で2011年におけるトップイノベーションの第5位にランクインし、世界的に非常に注目が集まっております。
N-SIMは、当センターのStation-5になりますので、機器の詳細はこちらをご覧ください。
構造化照明型超解像顕微鏡(N-SIM)で観察した動画
上記のように、N-SIMでは、生きている細胞での高速画像取得から3次元モデルを作成したり、あるいはタイムラプス観察を行うことも可能です。そこで以下では、タイムラプス観察や、3次元モデルの動画を紹介いたします。当センターの超解像顕微鏡の利用を検討されている方は、ぜひご覧ください。
*Webサイトでの表示の関係上、ファイルサイズ軽減の目的で、解像度を大幅に下げておりますことは、ご容赦ください。
GattaCell-4Cの3次元観察
ピンク:細胞核,
緑:ミトコンドリア,
紫:微小管.
オルガネラごとの動画では、高さによって表示色を変えています.
2D-SIMモードでタイムラプス観察
緑:ミトコンドリア(MitoTracker-Green),
マゼンダ:リゾソーム(LysoTracker-Red).
10秒間隔・20分間の観察です.
2D-SIMモードで、培養細胞の超解像タイムラプス観察
TubulinTracker-DeepRedで染色したHeLa細胞を、5秒間隔・10分間の観察を行いました.
2D-SIMモードで、培養細胞の超解像タイムラプス観察
緑:微小管(TubulinTracker-DeepRed),
マゼンタ:細胞核(Hoechst33342)
30分間隔・8時間の観察を行いました.
3D-SIMモードで、生きている細胞の高速超解像3次元観察
3分程度のXYZ観察から、細胞内のミトコンドリアの分布や構造を3次元で高精細に検討できます.
3D-SIMモードで、生きている細胞の高速超解像3次元観察
更にズームアップすると、生きている細胞のミトコンドリア内膜の観察も可能です.
3D-SIMモードで、生きている細胞の高速超解像3次元観察
青:細胞核(Hoechst),
緑:ミトコンドリア(MitoTracker-Green),
赤:リゾソーム(LysoTracker-Red),
紫:微小管(TubulinTracker-DeepRed).
多重蛍光標識により、さまざまな細胞内器官の3次元観察もできます.
ホウセンカの茎の共焦点観察・超解像観察の比較
共焦点顕微鏡よりZ分解能が向上し、縦方向に締まって観えます.
トウモロコシの茎の3次元超解像観察
「マイクロ・マカロン」と呼びたくなる、直径3ミクロン程度の構造も、明瞭に観察できております.
ネンジュモの3次元超解像観察
シイタケの菌褶の3次元超解像観察の比較
要はシイタケの断面ですが、数マイクロメートルサイズのチューブが重なり合っており、個々の識別が可能です.
ゼニゴケの3次元超解像観察
マツ花粉の3次元超解像観察
ゼニゴケの胞子と弾糸の3次元超解像観察.
こちらはサンプルの自家蛍光での観察となりますが、2つのリボンによる2重らせん構造のような様子が観察できました。
ムクゲの茎の横断面の3次元超解像観察.
トウモロコシ茎の横断と同様に、数マイクロメートル程度の構造が明瞭に観察できました。
※以上の植物サンプルは、株式会社ヤガミの「植物組織プレパラート(40種)」(理科の実習用)になります。
ニコンの超解像顕微鏡:N-STORMに関して
※当センターには、「N-STORM」などの1分子局在化顕微鏡はございませんが、観察方法の紹介として以下に記します。
通常の蛍光観察法では、「強い光の照射のため、Z方向も含めた視野内の全分子が同時に励起する」ことになります。そのため上記に記した光学限界により、光学分解能の範囲内で近隣している蛍光分子を”分けること”ができず、「見えているものは、1個の粒子なのか?それとも近隣にある複数の粒子なのか?」の識別ができません。
ニコンで展開しているN-STORMは、1分子局在化顕微観察法の一つにあたります。
この1分子局在化顕微観察法は、光学系として全反射蛍光光学系(TIRF)をベースとしており、このためガラス基板のすぐ上の数百ナノメートルのみにしか励起光が届きません。そして励起光が当たっても、確率的にごく少数の蛍光分子のみが光る状態としておき、なおかつ極めて弱い光を励起光として照射して観察します。このため、蛍光を発する分子はごく低確率となりますので、分子1個に由来する蛍光画像が取得できます。この段階では光学分解能の観点から、実際の分子1個のサイズより遥かに大きな円が観察されますが、画像演算処理によって円の中心位置が算出できます。
1分子局在化顕微観察法は、上記の原理で数千枚以上もの多くの画像を取得し、その個々の画像から個々の蛍光分子の位置を正確に把握した、高分解能の画像を再構築いたします(この原理が、平成26年のノーベル化学賞の対象となりました)。
*光る分子の割合が非常に小さいので、隣接する2分子が同時に蛍光を発する可能性は限りなく0に近く、そのため他の種類の光学顕微鏡では隣接する蛍光が重なり合って識別できなかったシグナルの分離・識別ができます。
また全反射光学系のため、XY位置が同じでZ位置のみが異なる可能性も排除できます。
例としては―超高層ビルで「204号室」とだけ言われても、各階に204号室があるのなら1階か32階か、はたまた200階であるか判別できないですが、全反射光学系ではZ位置は最初から特定されており、ガラス基板のすぐ上の1階だけが対象なので、「1階の204号室!」となります。
ただしSTORMではTIRF光学系とする必要があるため、ガラス基板のすぐ上のみしか観察ができませんし、1枚の画像には僅かの分子の位置しか反映されない→数千枚の画像取得が必要となりますので、1枚の画像構築に数分程度の時間を要します。更に蛍光分子が光るか否かは、分子構造や化学平衡に大きく依存しております。実際に蛍光分子の大部分を光りにくくするためには、還元剤を投与して高精度に化学平衡を調節する必要があり、この場合は生きた細胞試料の観察はできません。
このため現状では、まだ発展途中の手法であり、細胞内小器官や生体分子の位置をリアルタイムに把握することは、現在では”誰でも可能”とは言いがたいです。しかし従来の十分の一、20nmという超高分解能が達成できますのは、非常に大きなメリットです。日常的に電子顕微鏡用のサンプルを作成して観察を行っているような方ですと、STORM用サンプルの作成は容易です。
もちろん試薬やカメラ、あるいはソフトウエアの開発で、飛躍的に観察手法が改善される可能性が高いですので、ぜひ今後に期待してくださればと思います。当初このページを作成した平成24年・26年と比較しても、数年で大幅に改善された点も多々あり、近い将来には生きた細胞での観察も行えるようになると推測されます。
*観察方法や詳細は、上記のリンク先や、[Nikon: Single-Molecule Super-Resolution Imaging](こちらは英語です)などを、ぜひ参考としてください。
また当センターでは、画像解析による超解像化:SRRFについても、紹介を行っております。
SRRFの詳細は以下をご覧ください。