※当センターでは、現在はHuygensの提供は終了いたしましたが、デコンボリューションの紹介として以下に掲載いたします。
※また、以下に掲載している顕微鏡画像や動画の無断使用を禁止いたします。
Huygensとデコンボリューションの概略

ソリューションシステムズ社から以前に提供のソフトウエア:Huygens(ホイヘンス)は、デコンボリューション処理を行うソフトウエアです。 デコンボリューションとは、点(蛍)光源が焦点面以外でどのようにボケるかを考慮することにより、焦点面以外からの蛍光を数学的処理によって除去する手法で、焦点面の上下の面の蛍光に由来する画像のボケやにじみが取り除かれるため、空間解像度をより高めることが可能です。
共焦点観察法は焦点面以外の蛍光を排除することができる手法ではありますが、それでも非焦点面以外からの蛍光をすべて完全に除去することはできません。そのため少なからずのボケが含まれてしまいますが、このデコンボリューション処理によって更なる画質改善が可能となり、超解像顕微鏡で取得したような画像とできる―可能性もあります。
デコンボリューションは既に確立した画像処理手法であり、データーの改変にはあたりませんので、論文で処理方法やソフトウエア名を記載すれば全く問題ありません(論文での記載例)。Google-Scholarで”Huygens, Scientific Volume Imaging(SVI社, Huygensの開発メーカー)”で論文の掲載本数を調べると、2000年-2022年6月の期間で3790報があり(毎年100報以上も増えており、この1年では400報も増加した模様です)、この分野での一流誌にも既に数多く報告されております。
詳細は、ソリューションシステムズ社のページや、SVI社のHuygens紹介のページ(こちらは日本語に訳されております。また上部メニューで、[Applications : Images : Image / Movie Gallery]には、各種デコンボリューション処理例も掲載されています)、あるいは下記よりサンプル画像をご覧下さい。
※参考 ソリューションシステムズ:なぜデコンボリューションが必要か
Huygensの特長
- Z方向には画像を取得していない1枚のみの画像でも、点像分布関数―Zを変えると点(蛍)光源がどのようにボケるか―の理論値を適用することで、デコンボリューションが可能です。
- 複数画像の連続処理も可能であるため、 多チャンネルのタイムラプスデータを、一度に処理することもできます。
- 落射蛍光像(ステーション3)はもちろんのこと、非焦点面からの蛍光が排除されている共焦点顕微鏡(ステーション1,2,4)の画像でも、更なる画質改善が期待できます。以下の画像例をご覧ください。
- 付属のビューアーで3次元レンダリング像を表示し、それを拡大/回転させた動画の作成も可能です。
デコンボリューションでの注意点
- 励起光や蛍光の波長はもちろんのこと、対物レンズの情報、ピンホールサイズなど、数種のパラメーターの正確な設定が必要です。オリジナルデータが展開できても、実際の処理前には各パラメーターの再確認が望ましいところです。
- また上記の点像分布関数とは、“蛍光ビーズをZ方向にスキャンした際の蛍光像=理想的条件から、どれだけのボケが生じるか”になります。そのため、このデータを処理の際に適用すると、それぞれの顕微鏡固有の光学特性を反映させられますので、更なる画質改善が可能となります(蛍光ビーズは、デコンボリューション補正用(0.17um)のPS-Speckが理想的です)。
- 処理を行うオリジナル画像は、各チャンネルでグレースケール(モノクロ)のTIF形式画像(連番のファイル名となっている)が標準です。最近のHuygensでは、顕微鏡メーカーのソフトウエアオリジナルの保存形式のままでも処理可能です。しかし多次元データの場合など、必ずしも全てが完全に反映されてはいないことも考えられます。そのため初回のトライアルだけでも、オリジナルデータに加えてTIF形式ファイルも用意してもらうのが確実です(パラメーターはメモしてください)。当センターには、他の顕微鏡メーカーのソフトウエアはありません。
- そしてオリジナル画像は、フォーカスが十分に合っていて、輝度範囲を12ビットや16ビットの設定として撮った、十分に明るい画像であることが必要です。この設定で取得したものの、結果的にあまり輝度が高くなく、8bitの範囲:0-255となってしまっても概ね問題ありませんが、一方でCCD/CMOSカメラで最初から8ビット設定(256階調)で取得した画像は、明らかにSN比が小さいため、適しておりません。これはHuygensでのデコンボリューションに限らず、一般的な画像処理・解析においても概ね同様です。
Huygensでのデコンボリューション処理の例
落射蛍光画像のデコンボリューション処理の例
オリジナル画像の画質が優れている(フォーカスが完全に合っている、バックグラウンドと比較して十分な輝度がある)ならば、落射蛍光像でのデコンボリューション処理により、共焦点顕微鏡や超解像顕微鏡で取得したかのような画像を得ることも可能です。細胞核の周囲(細胞の中央付近)は厚みがあるため、蛍光観察では見えている高さから少し上下の位置にあるオルガネラに由来するボケが生じやすいですが、デコンボリューション処理でほぼ完全に除去できていることがわかります。
以下での既製スライドガラスサンプルとして、ThermoFisherのFluoCells#2と、ナノシード社のGattaCells-4C/ -1Cを利用しております。
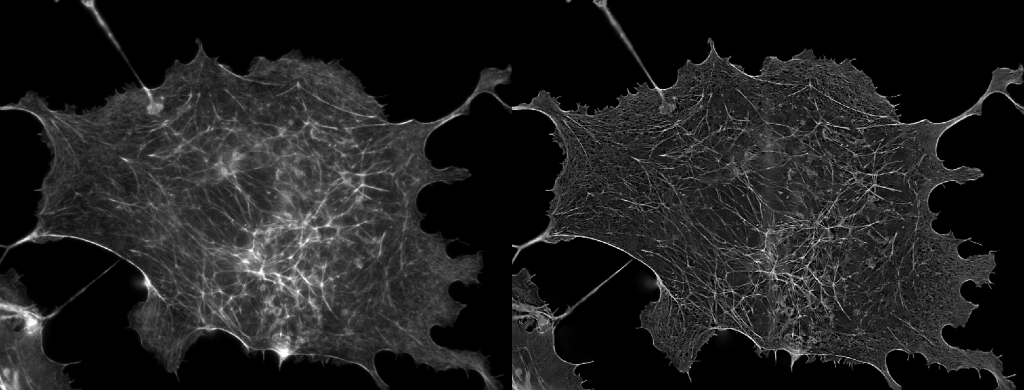
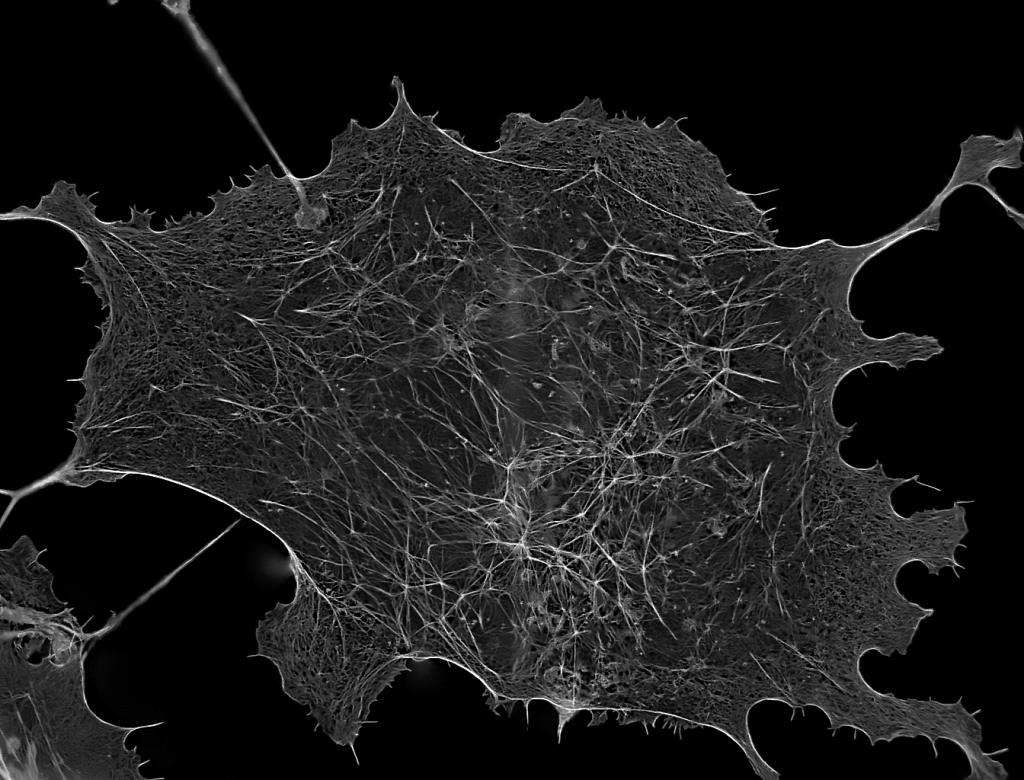

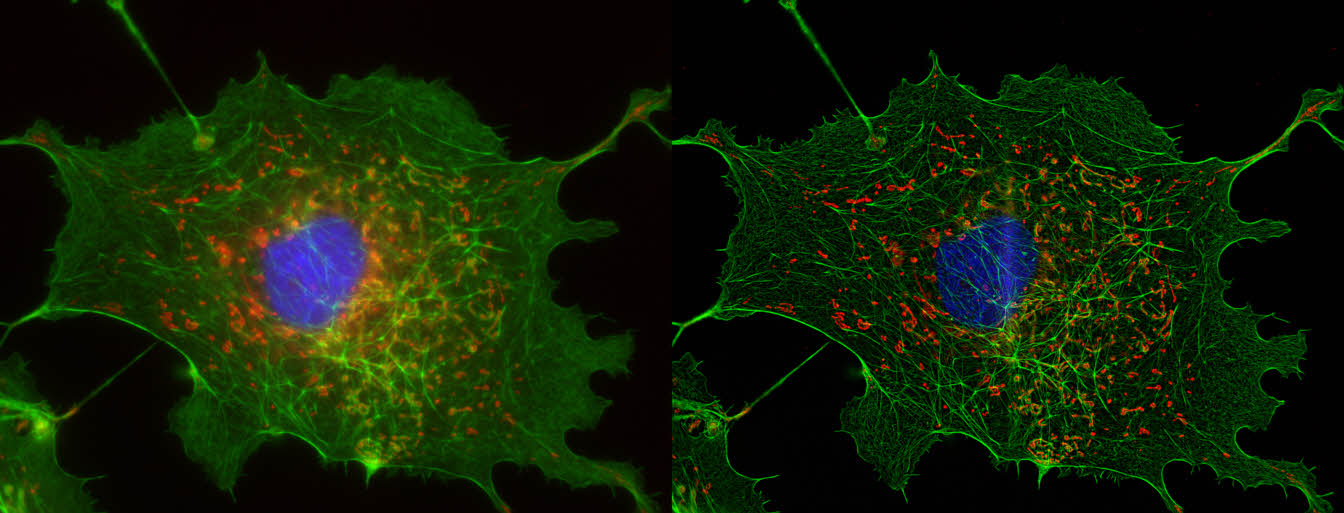
| 例1. 多重染色HeLa細胞. 青:細胞核(Hoechst), 緑:ミトコンドリア(MitoTracker-Green), 赤:リゾソーム(LysoTracker-Red). |
| 例2. FluoCells#2サンプル. 青:細胞核(DAPI), 緑:チューブリン(BODYPY), 赤:アクチン(Texas-Red). |
| 例3. FluoCells#2サンプル. 青:細胞核(DAPI), 緑:チューブリン(BODYPY), 赤:アクチン(Texas-Red). |
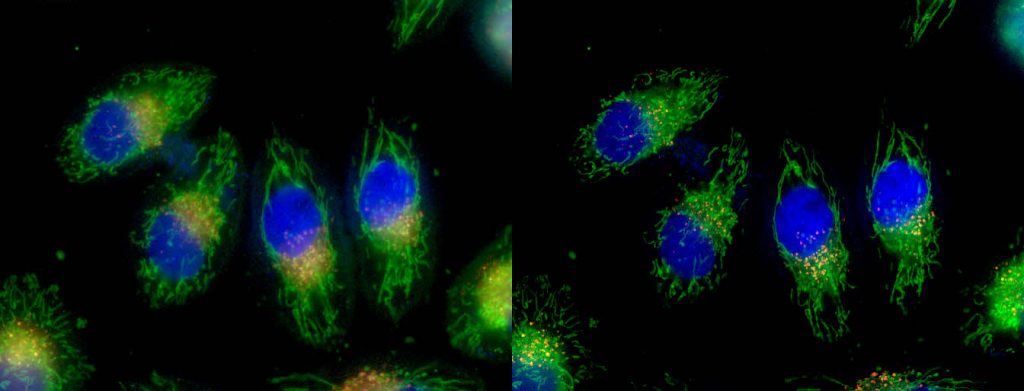
| 例4. 染色HeLa細胞. 微小管をTubulinTracker-Greenで染色したHeLa細胞(ライブセルイメージング) |
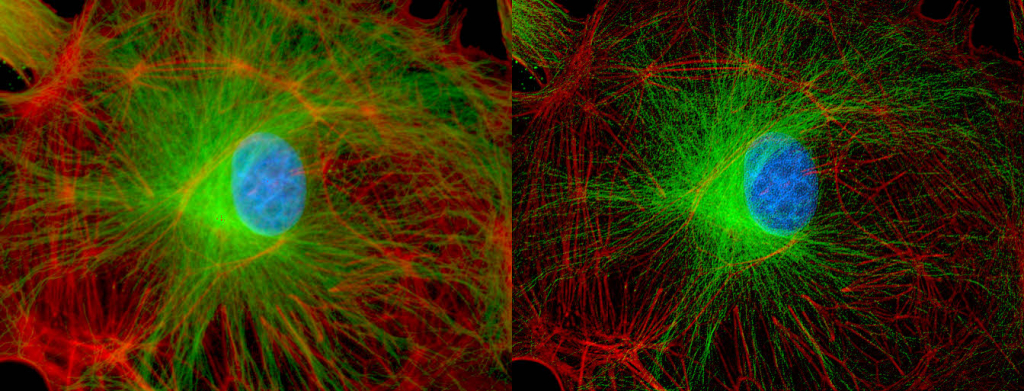
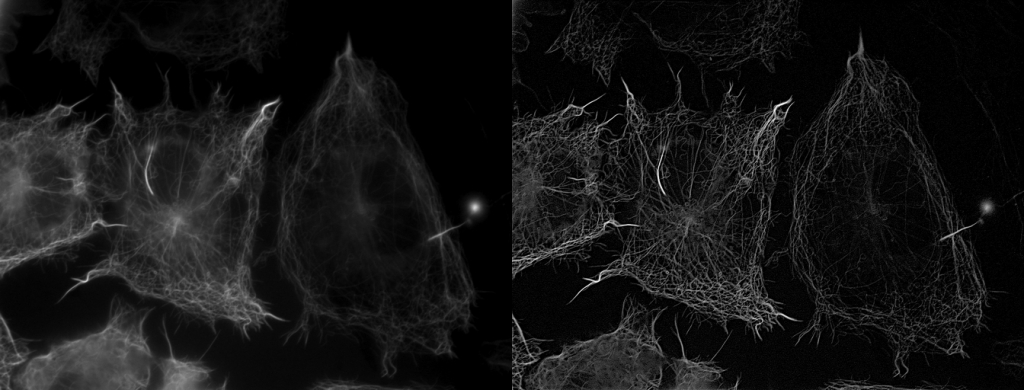
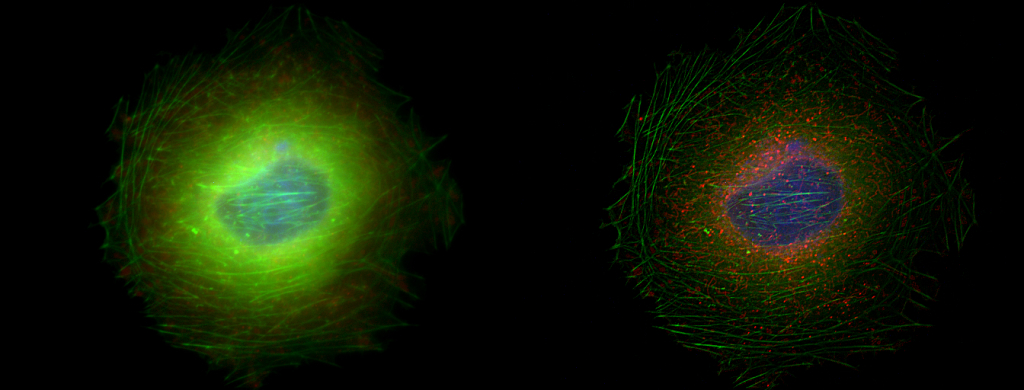
| 例5. 多重染色COS7細胞. 青:細胞核(Hoechst), 緑:アクチン(ActinGreen-ReadyProbes), 赤:ミトコンドリア(MitoTracker-Red). |
| 例6. 例5のアクチンのみの比較. 白:アクチン(ActinGreen-ReadyProbes). |
| 例7. 例5のアクチンのデコンボリューション処理済みの画像. 白:アクチン(ActinGreen-ReadyProbes)。 一般の蛍光顕微鏡で取得した画像も、共焦点顕微鏡や、更には超解像顕微鏡で取得した画像のようになります。 |
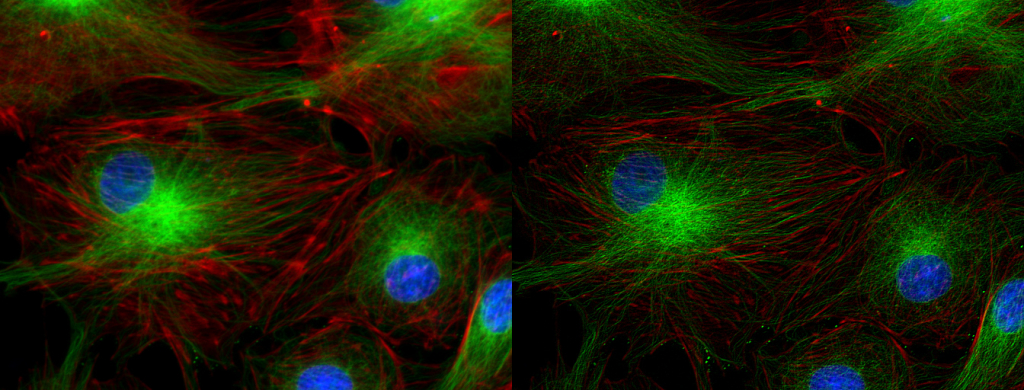
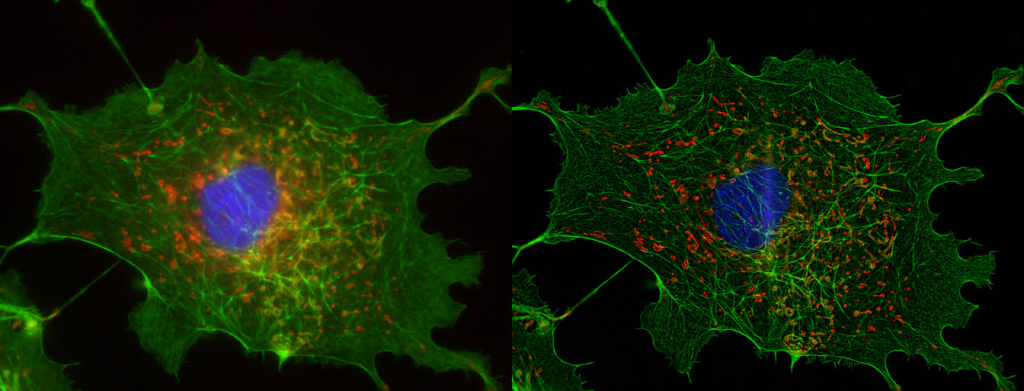
| 例8. 蛍光タンパク質が多重発現したHeLa細胞(例9と同じ細胞). 青:細胞核(Hoechst), 水色:小胞体(CFP発現), 赤:ミトコンドリア(mCherry発現). |
| 例9. 蛍光タンパク質が多重発現したHeLa細胞(例8と同じ細胞). 青:細胞核(Hoechst), 緑:アクチン(Venus発現), 赤:ミトコンドリア(mCherry発現). このサンプルの作成と提供:大阪大学 産業科学研究所 生体分子機能科学研究分野 永井健治先生, 東京医科歯科大学 齊藤健太先生 |
細胞分裂ムービーでのデコンボリューションの比較
白:細胞核(Hoechst染色), 緑:ミトコンドリア
デコンボリューションによって、細胞核から徐々に染色体が形成される様子も明瞭になることが(厳密には、HoechstはDNAの2重らせんの間に入り込みます)、またミトコンドリアも1本ずつより鮮明に観察できるようになったのがわかるかと思われます。
共焦点顕微鏡画像のデコンボリューション処理の例
非焦点面以外に由来する蛍光を取り除く手法である共焦点観察画像でも、にじみを除去して空間解像度を更に高めることができます。初見では既に十分くっきり見えていると思われますが、デコンボリューション処理後の画像を一回見てしまうと、まだまだ画質改善の余地があるような印象となります。
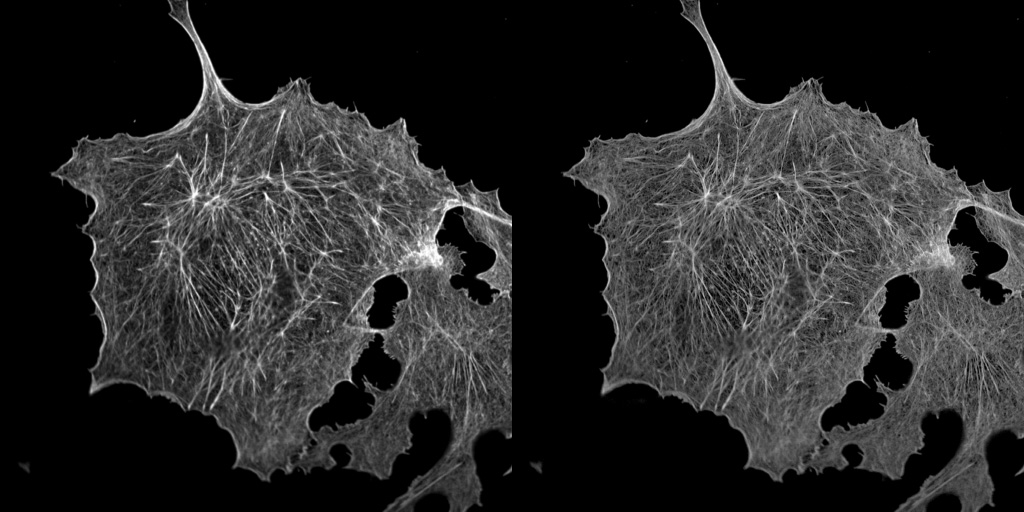
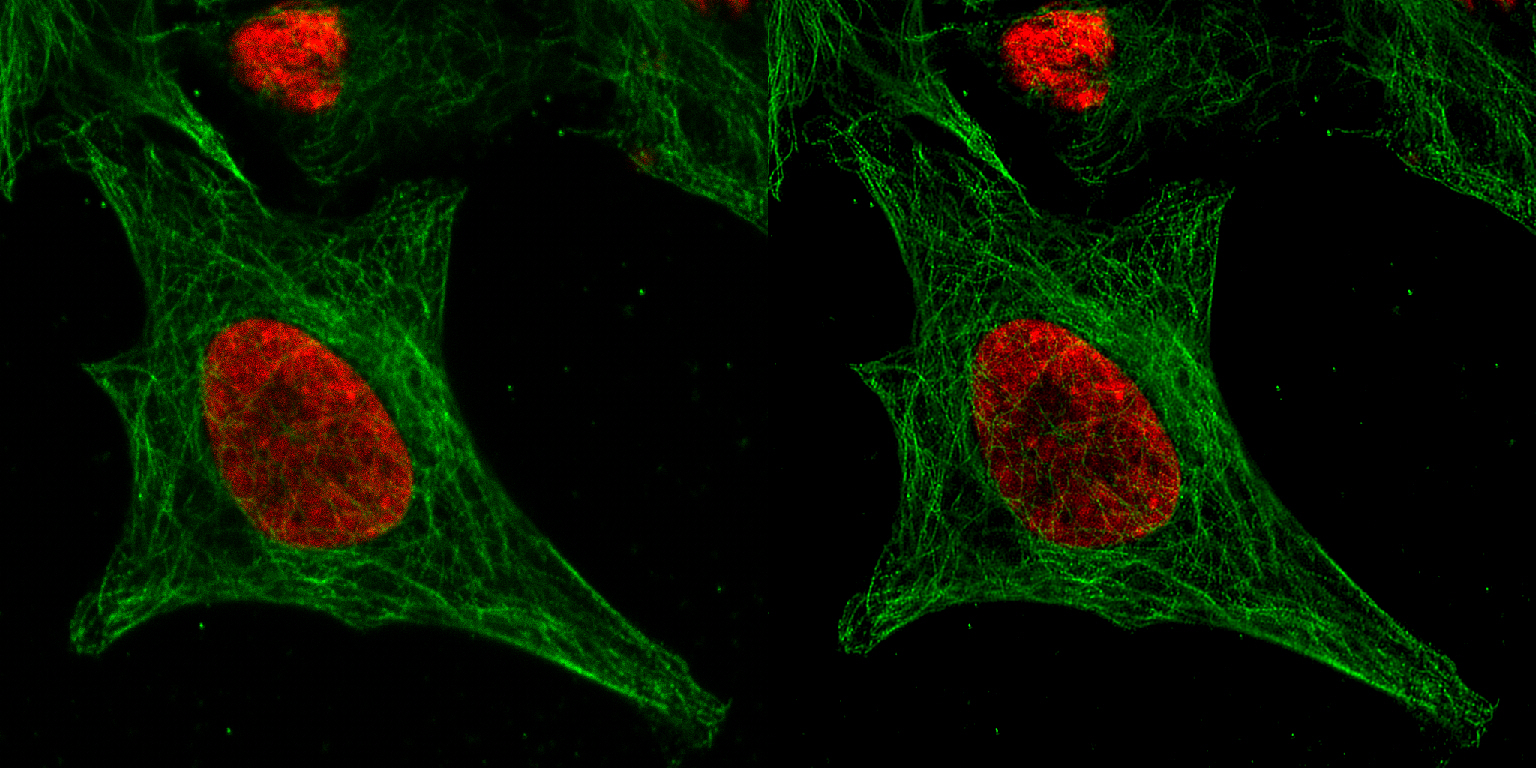

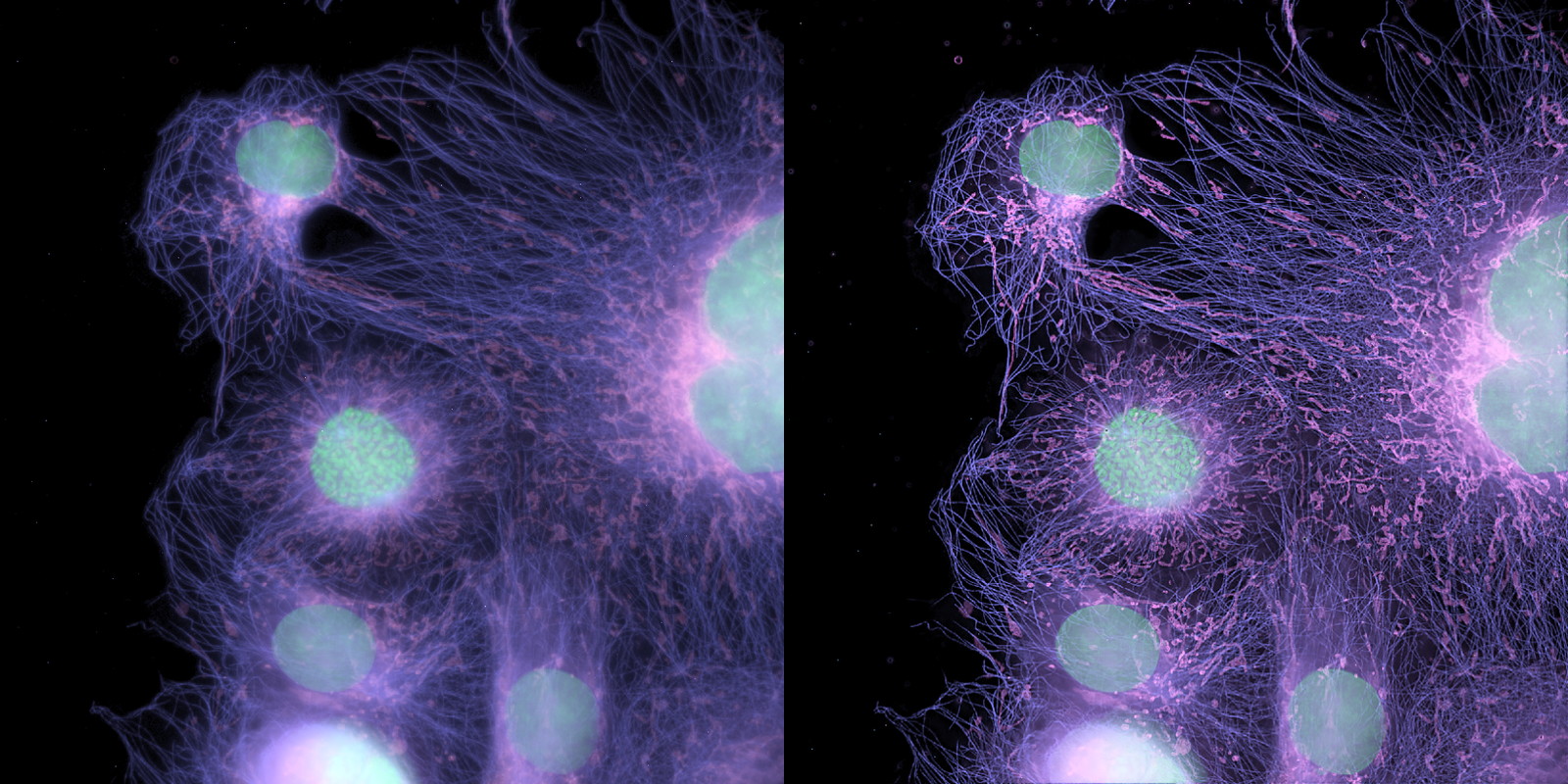
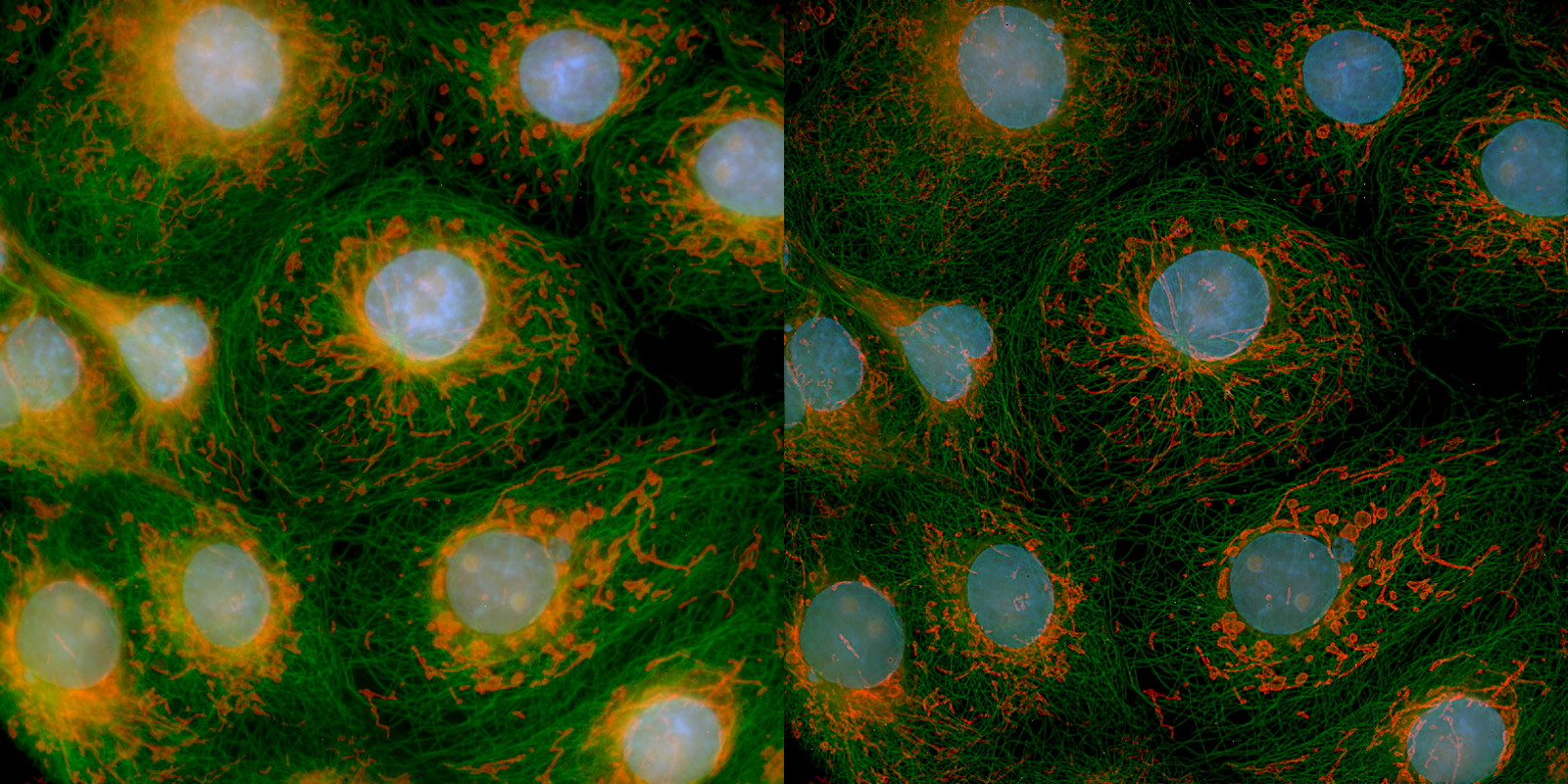
| 例1. アクチンを染色したCOS7細胞(固定). 白:ActinGreen-ReadyProbesで染色したアクチン. 太い線維も細い線維も、一層鮮明に見えるようになりました. |
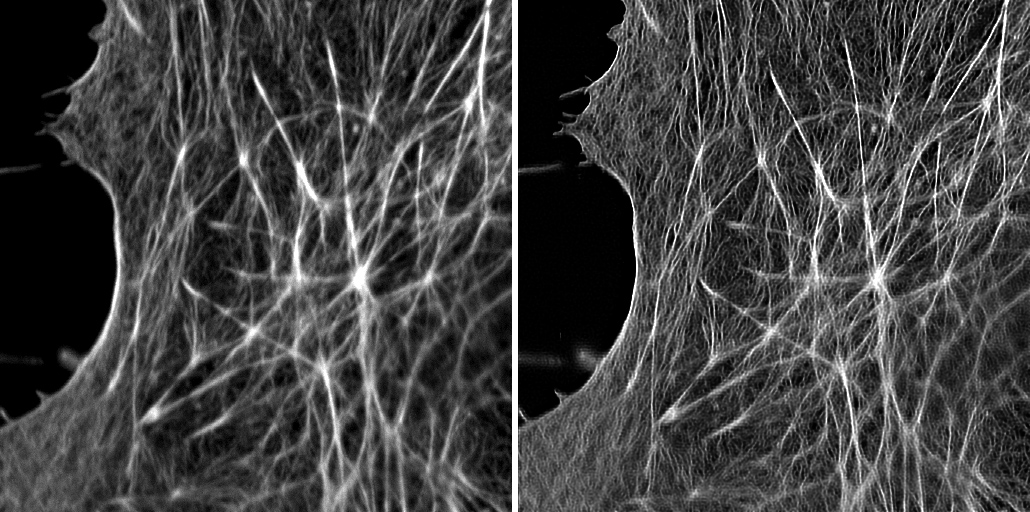
| 例2. 例1を更に拡大。処理前はノイズレベルと大差ないような細い線維も、明瞭に見えるようになりました。処理前に重なっていた箇所は、他の焦点面由来の蛍光(ボケ)が除去できたことも確認できると思われます. |
| 例3. 対物レンズが異なる画像の比較. 左:20倍の対物レンズ(ドライ用,NA:0.75)で取得し、デコンボリューションをした画像, 右:60倍の対物レンズ(油浸, NA:1.40)で取得し、デコンボリューションしていない画像。緑:α-チューブリン(Alexa546), マゼンダ:細胞核(Hoechst33342).20倍の対物レンズでも、60倍と遜色ない画像となります。高倍率のレンズが使えない場合も、鮮明な画像とすることが可能です. |
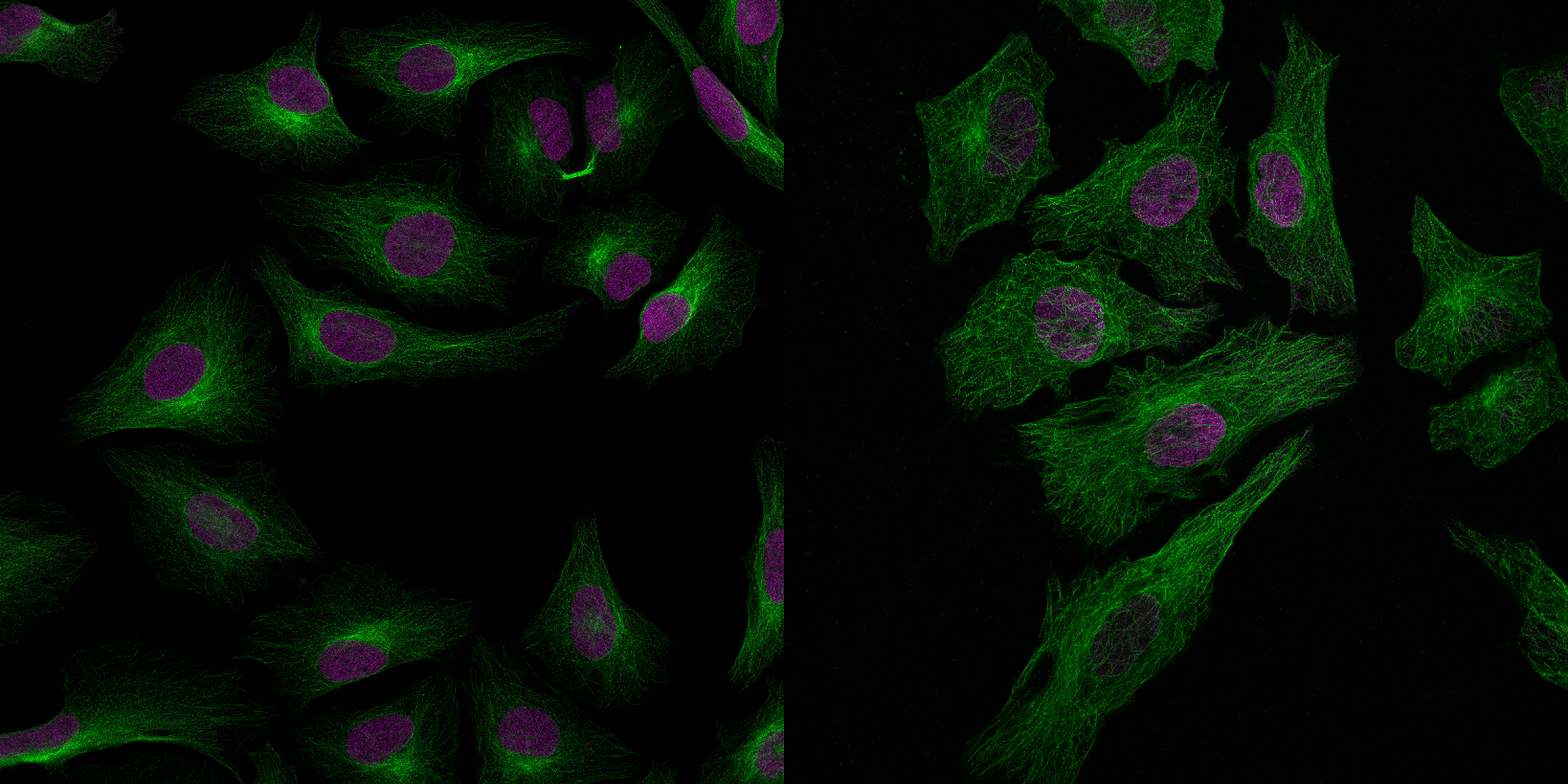
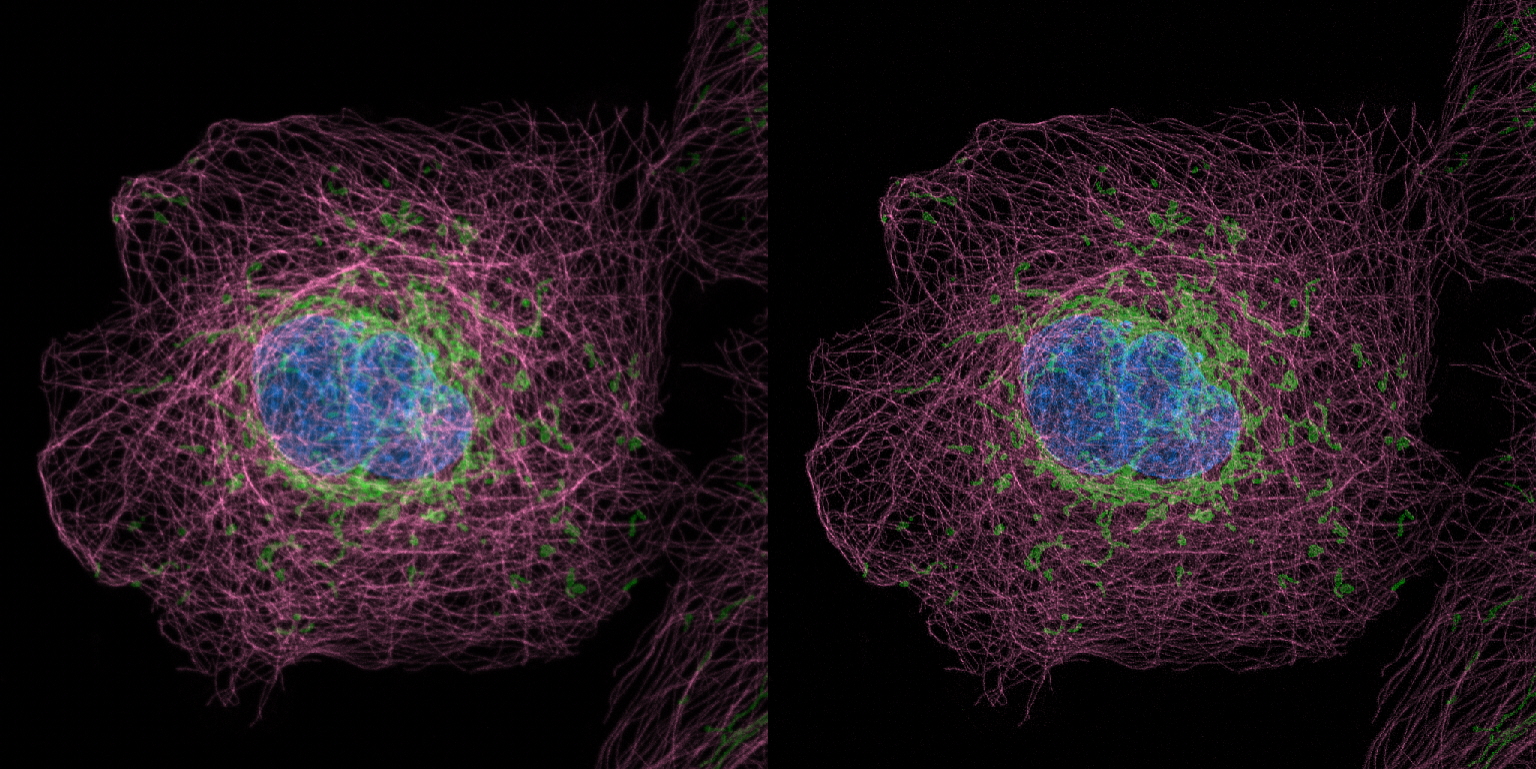
| 例4. 2重染色HeLa細胞. 赤:細胞核(Hoechst33342), 緑:チューブリン(Alexa546). 特にパラメーターの最適化は行わず、簡易設定(Huygens-Express)で処理しましたが、超解像顕微鏡で観察したかのような画像も、わずか3分足らずで作成できました. |
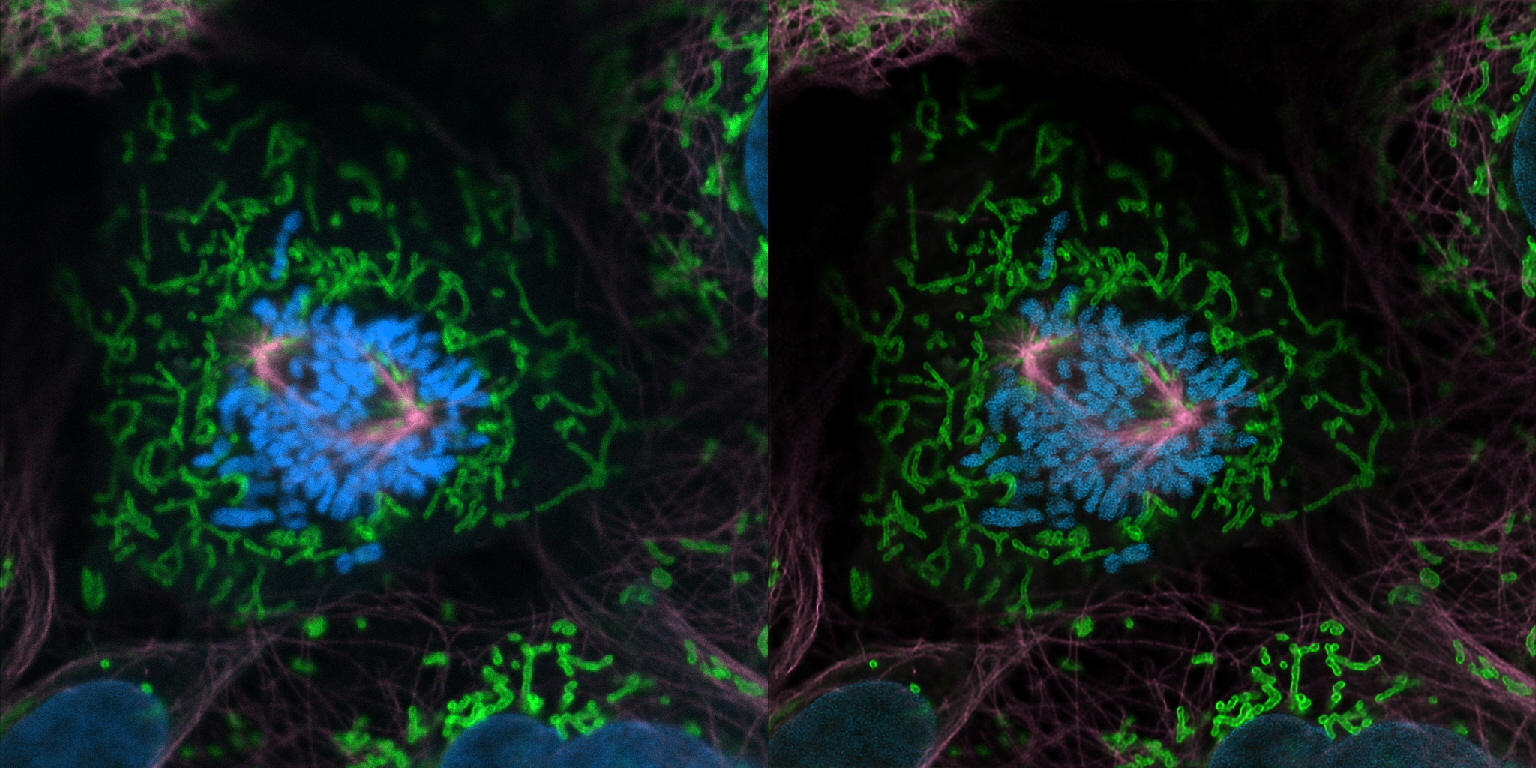
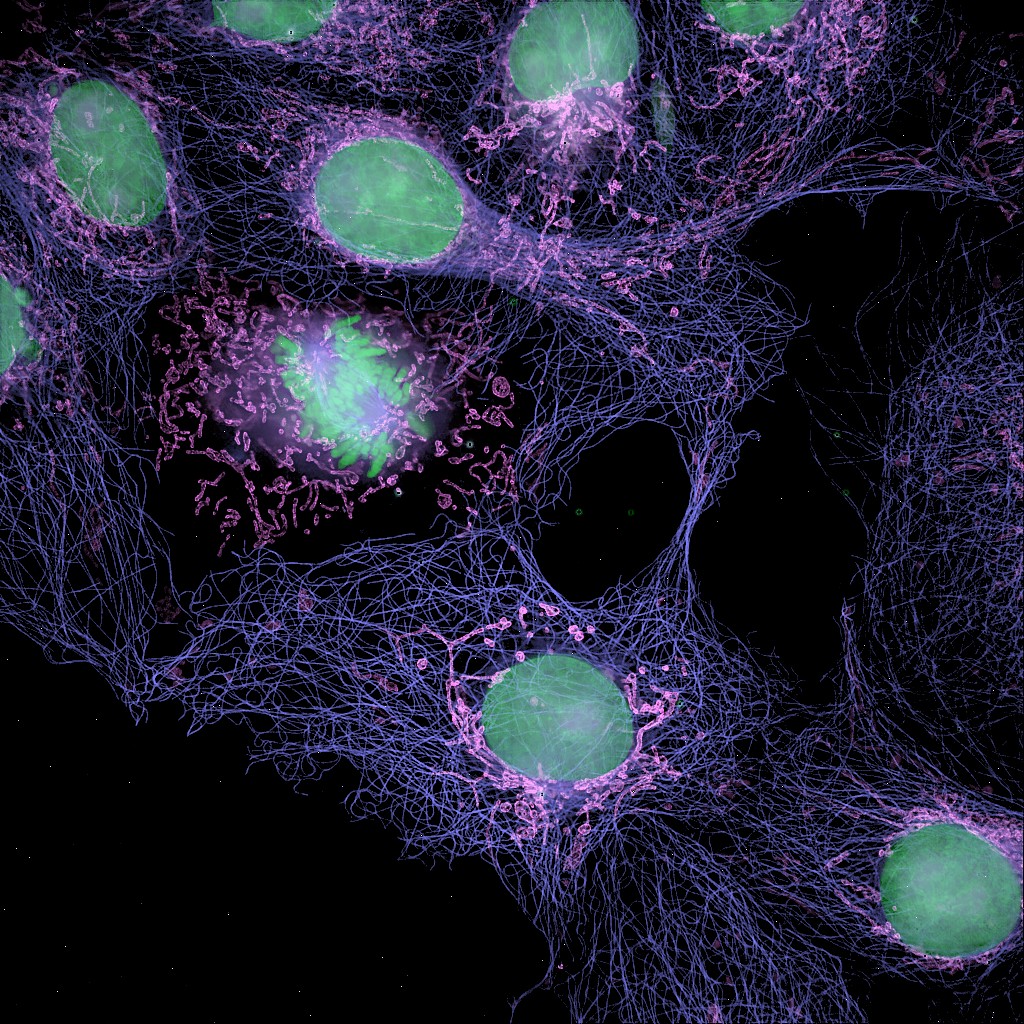
| 例5. GattaCells-4Cサンプル. 青:細胞核(DAPI), 緑:ミトコンドリア(Anti-TOm20-OregonGreen 488), 桃色:微小管(TMR-Tubulin). |
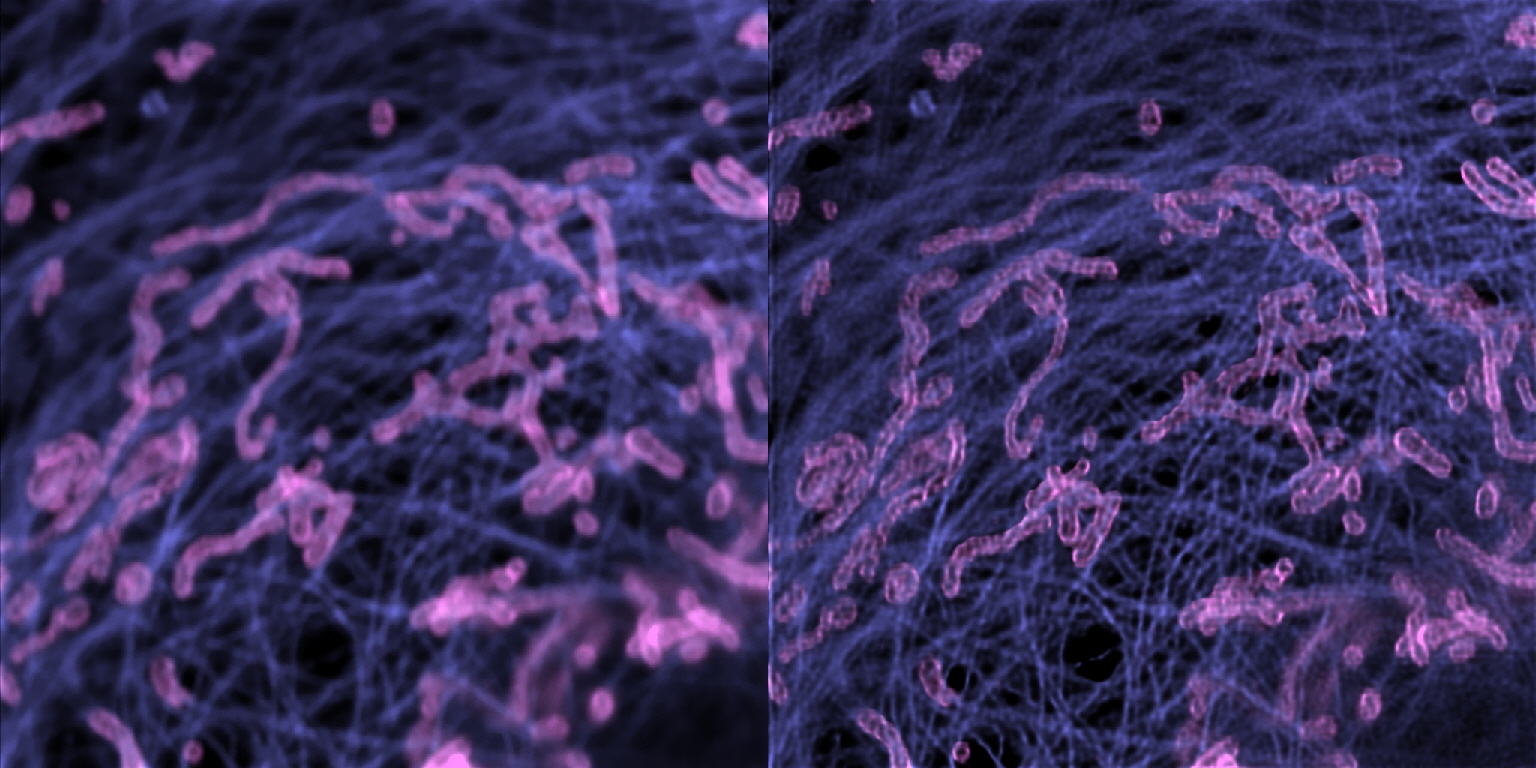
| 例6. GattaCells-4Cサンプルで、例5の一部を拡大.桃色:ミトコンドリア(Anti-TOm20-OregonGreen 488), 紫:微小管(TMR-Tubulin). |
| 例7. GattaCells-4Cサンプル. 青:細胞核(DAPI), 緑:ミトコンドリア(Anti-TOm20-OregonGreen 488), 桃色:微小管(TMR-Tubulin). |
| 例8. GattaCells-1Cサンプル. 黄:核膜孔複合体 (nuclear Pore Complex/NPC):Anti-Nup with Alexa Fluor®︎ 555. |
| 例9. GattaCells-4Cサンプル. 緑:細胞核(DAPI), 桃:ミトコンドリア(Anti-TOm20-OregonGreen 488), 紫:微小管(TMR-Tubulin). |
| 例10. GattaCells-4Cサンプル. 緑:細胞核(DAPI), 桃:ミトコンドリア(Anti-TOm20-OregonGreen 488), 紫:微小管(TMR-Tubulin). |
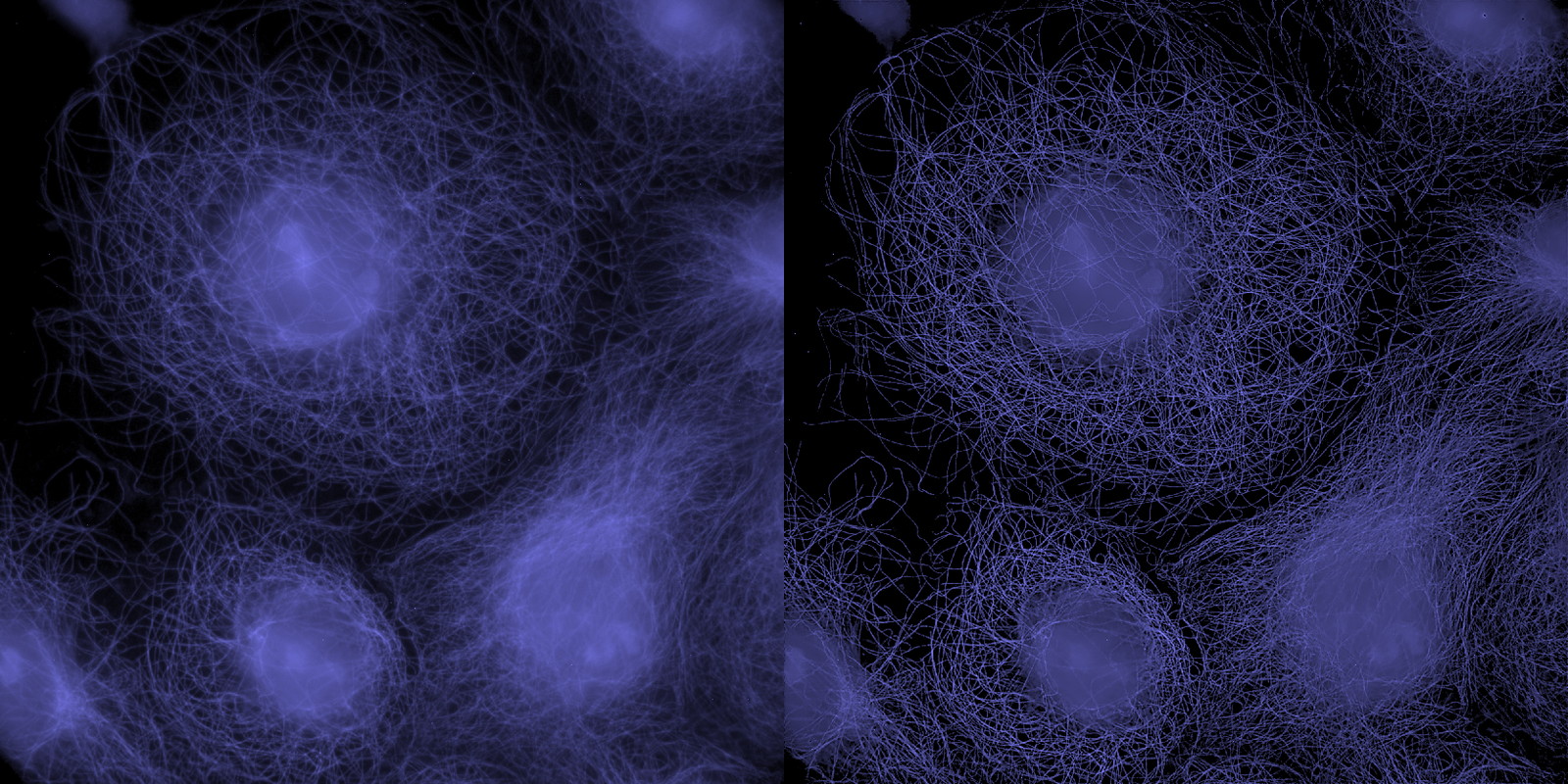
| 例11. GattaCells-4Cサンプル. 紫:微小管(TMR-Tubulin). |
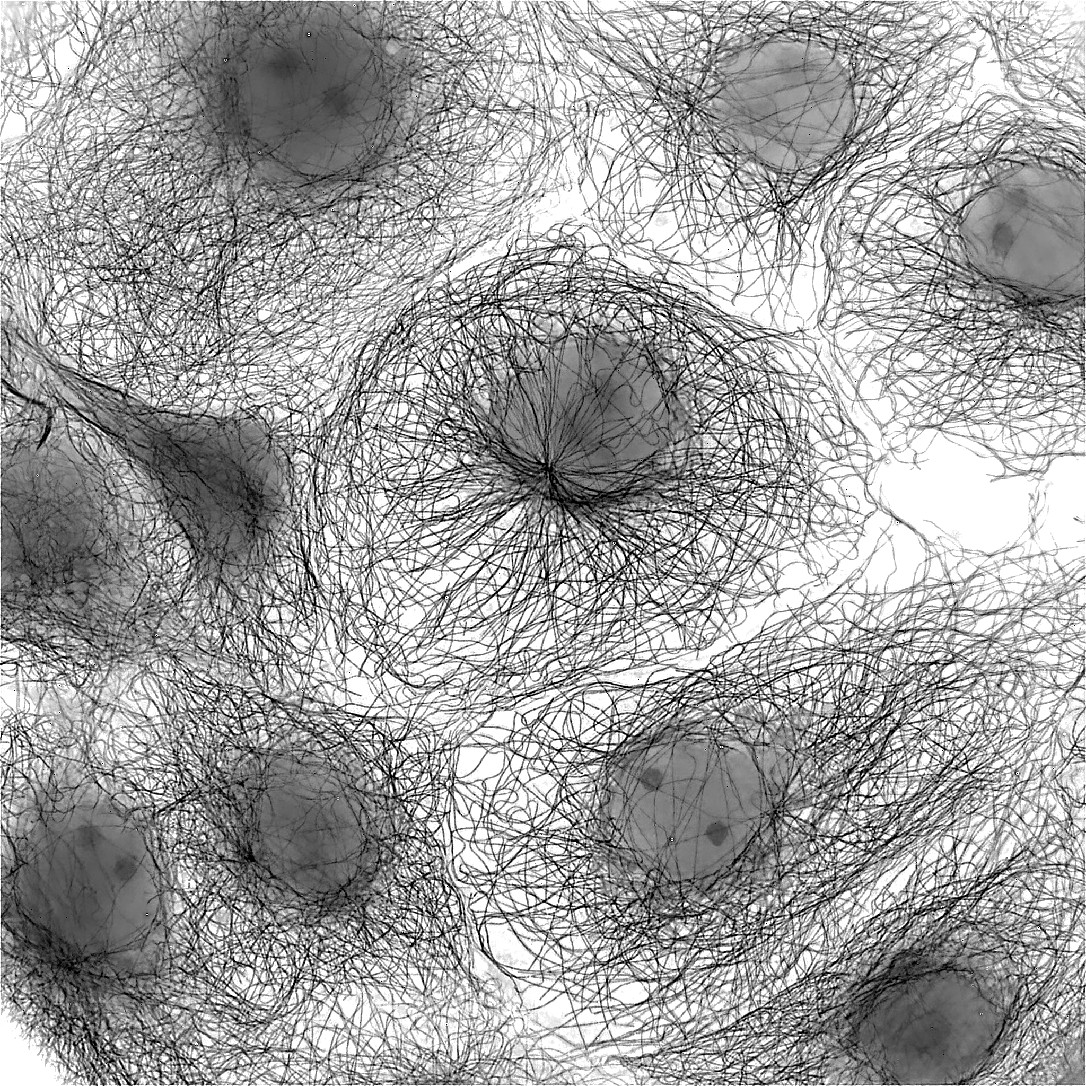
| 例12. GattaCells-4Cサンプル. 白:微小管(TMR-Tubulin). |
| 例13. GattaCells-4Cサンプル.青:細胞核(DAPI), 赤:ミトコンドリア(Anti-TOm20-OregonGreen 488), 緑:微小管(TMR-Tubulin) |
培養細胞の微小管末端(EB1)のタイムラプス観察でのデコンボリューション処理の比較. 上:デコンボリューション後; 下:デコンボリューション前
微小管末端(EB1)にGFPを発現させた培養細胞を、毎秒1枚、約1分間にわたる共焦点観察を行いました。デコンボリューションによって微小管末端は更に明瞭に可視化されるため、更に綿密な微小管動態の検討が可能となります。
※このサンプルの作成と提供 北海道大学 理学研究院 高橋正行先生; 東北大学 大学院医学研究科 上条桂樹先生
固定細胞の微小管の共焦点観察をZ方向に連続取得して、回転像を構築.
※サンプルは、ナノシード社のGattaCells-4Cを用いました。
固定細胞のミトコンドリアと微小管の共焦点観察画像から、回転像を構築.
デコンボリューション処理により、1本1本のミトコンドリアはZ方向にもかなり鮮明な像となり、断面もきれいに見えることがうかがえるかと思われます。
※サンプルは、ナノシード社のGattaCells-4Cを用いました。
Huygensでの3次元表示の例
視点方向を自由に定めた3次元レンダリング画像や、ズーム・回転させた3次元動画を作成することも可能です。SVI社のHuygens動画ギャラリーにも、3次元表示像など優れた各種サンプル画像・動画がありますので、こちらもぜひご覧ください。


Station-1で取得した、HeLa細胞(白:微小管(Alexa546), マゼンダ:細胞核)の3次元ムービー.
*画像提供: 自然科学研究機構 生命創成探究センター 堤元佐 博士(元イメージングセンター特任助教).