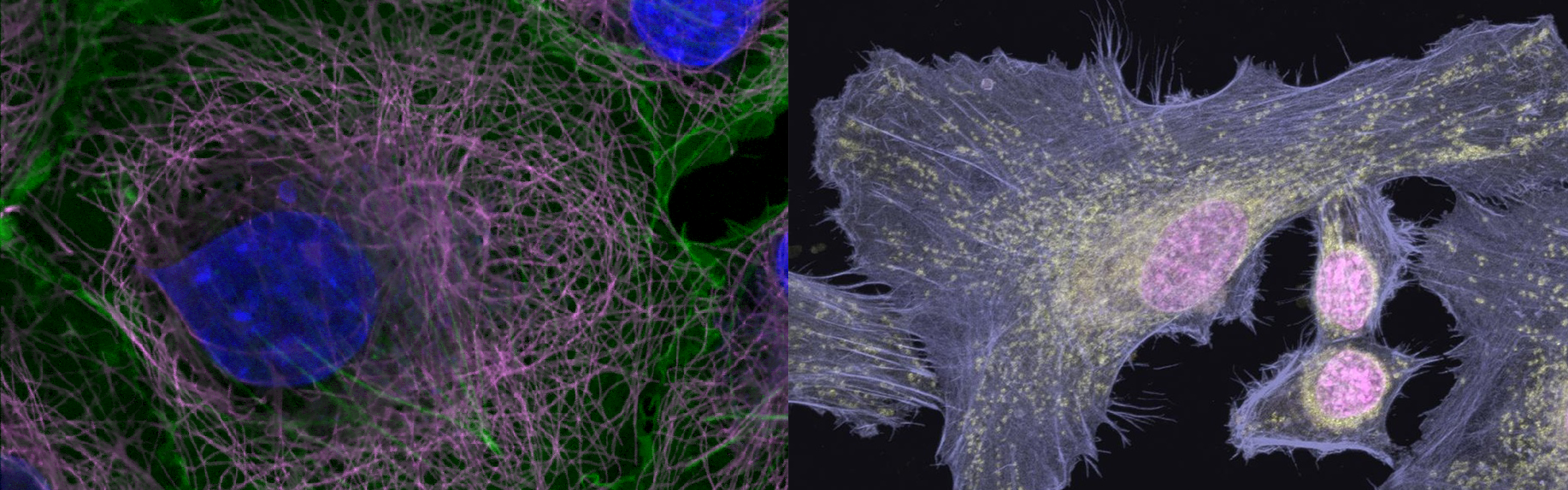
イメージングセンターのStation-1とStation-4は、ニコンの共焦点顕微鏡システム:Nikon A1Rsiで、ハイスペックな共焦点顕微鏡システムとなります。そこで以下では、実際に当センターで観察した画像とともに、A1の機能を紹介いたします。
※以下に掲載している顕微鏡画像や動画の無断使用は、禁止いたします。
A1で観察した、一般的な共焦点画像
A1で観察した、ごく一般的な細胞の画像例は、[イメージングギャラリー]に掲載予定ですので、もう少々お待ちください。
スペクトルモードと画像のアンミックス
Station-1:ニコンの共焦点顕微鏡:A1のスペクトルモードでは、取得した蛍光を回折格子で 2.5nm/6nm/10nm × 32チャンネルに分け、各ピクセル単位でのスペクトル情報を取得することが可能です。スペクトルイメージング法で取得した画像と、各成分単体のスペクトルとの比較により、多重蛍光の試料からアンミックス(各成分を分離)することができます。そのため、多重蛍光サンプルで蛍光スペクトルの重複が憂慮される場合でも、各成分を明瞭に分離することが可能ですし、バックグラウンド成分の除去にも適用できます。
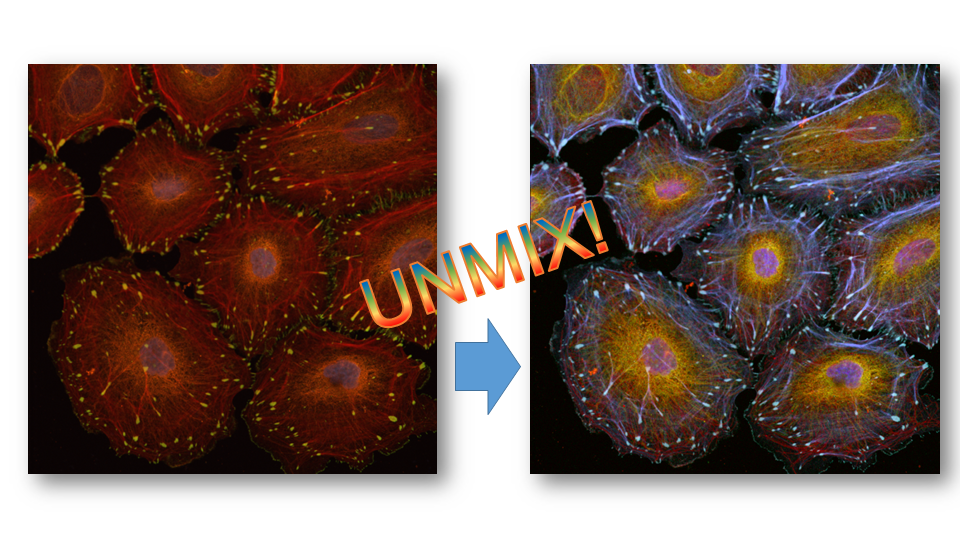
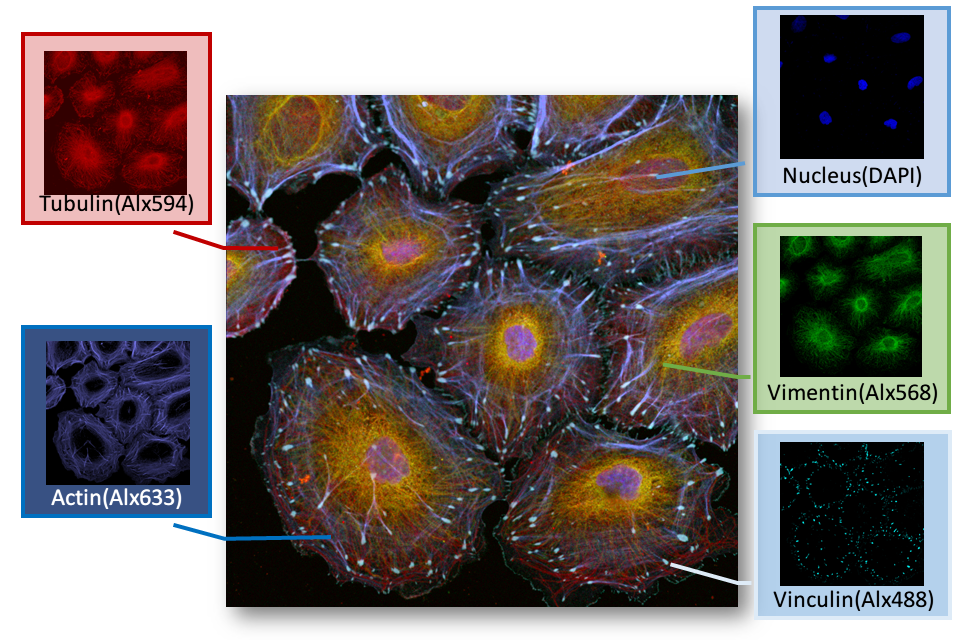
赤:Tubulin-Alexa594、 青紫:Actin(Phalloidin-Alexa633)
※ サンプルの作成と提供:久留米大学医学部 皮膚科学教室 辛島正志先生
高画質観察か?それとも高速観察か?
一般の蛍光顕微鏡はカメラで画像を撮影しますが、一方で共焦点顕微鏡ではレーザーが視野内全域を”スキャン”して画像を作成します。カメラは、”カシャッ!”と短時間で画像を取得できますが、一般の共焦点顕微鏡(ガルバノスキャン型)では画像取得に少し時間がかかり、XY解像度が512では1枚取得に1秒を、より高解像度の画像なら更に時間を要します。そのため超高速で起こる生物現象の観察には、残念ながら少し制約が生じてしまうのが実状です。
ニコンのA1には高速観察用スキャナも搭載されており、最速で毎秒230枚(512×64ピクセル)/33枚(512×512ピクセル)という超高速画像取得や、光刺激(現在は405nm)を行いながら同時に蛍光イメージングを行うことも可能です。
動画例:光刺激によって2種類の蛍光波長の比が変化するFRETタイプの蛍光タンパク質:Phamretが発現したHeLa細胞に、光刺激を行いながら高速共焦点観察(毎秒8枚程度で画像取得)。
このサンプルでは、Phamretは細胞質内に発現しており、刺激を受けたタンパクが細胞質に拡散していく様子をリアルタイムに捉えることが可能です
※サンプル提供 大阪大学 産業科学研究所 生体分子機能科学研究分野 松田知己先生・永井健治先生
3次元モデルの構築
通常の蛍光顕微鏡では、フォーカスが合っている面から少しずつZ位置を変えていっても、単にフォーカスがずれてゆくだけです。一方で共焦点顕微鏡では、試料のフォーカス面からの蛍光のみを取得するので、各Z位置でフォーカスが合った像=(水平)断面図を取得することができます。
Nikon:A1では、厚みのあるサンプルをスキャンし、その3次元モデルを構築することも容易に行えます。またニコンのソフトウエア: NIS-Elmementsでは、3次元モデルの回転像などの動画も簡単に作成できます。
動画例1 昆虫の触覚葉(一次嗅覚中枢)のニューロン構成
青:細胞核(DAPI染色)
緑:嗅覚介在ニューロン(FITC)
赤:嗅覚求心線維(ローダミン)
400μm(1000枚)にわたって、個々の糸球体の中で嗅覚求心線維と1個の嗅覚介在ニューロンの絡み付きを高精細で表現できました。ほぼ全ての嗅覚求心線維と嗅覚介在ニューロンを同時染色して共焦点観察できた例は、哺乳類も含めてほとんど例がないとのことです。
動画例2 ミツバチの一次嗅覚中枢(触覚葉)の糸球体構成
青:細胞核(DAPI染色)
緑:背側感覚神経(FITC)
赤:腹側感覚神経(ローダミン)
500μm程度にわたって、細かい嗅覚求心線維の表現に加え、触覚葉内部の中空構造も立体的にうまく表現できております。
動画例3 昆虫脳の巨大嗅覚応答性介在ニューロンの細胞内染色像.
ルシファーイエローで染色し、深度に応じた色表示(左スケール参照).
巨大ニューロンの細かい枝構造を、通常の共焦点顕微鏡を用いて600μm近くもの深さにわたって高精細に観察できました。
昆虫サンプルの作成と提供:北海道大学 電子科学研究所 人間数理研究分野 西野浩史先生
電動ステージを使って、広範囲の共焦点画像を取得
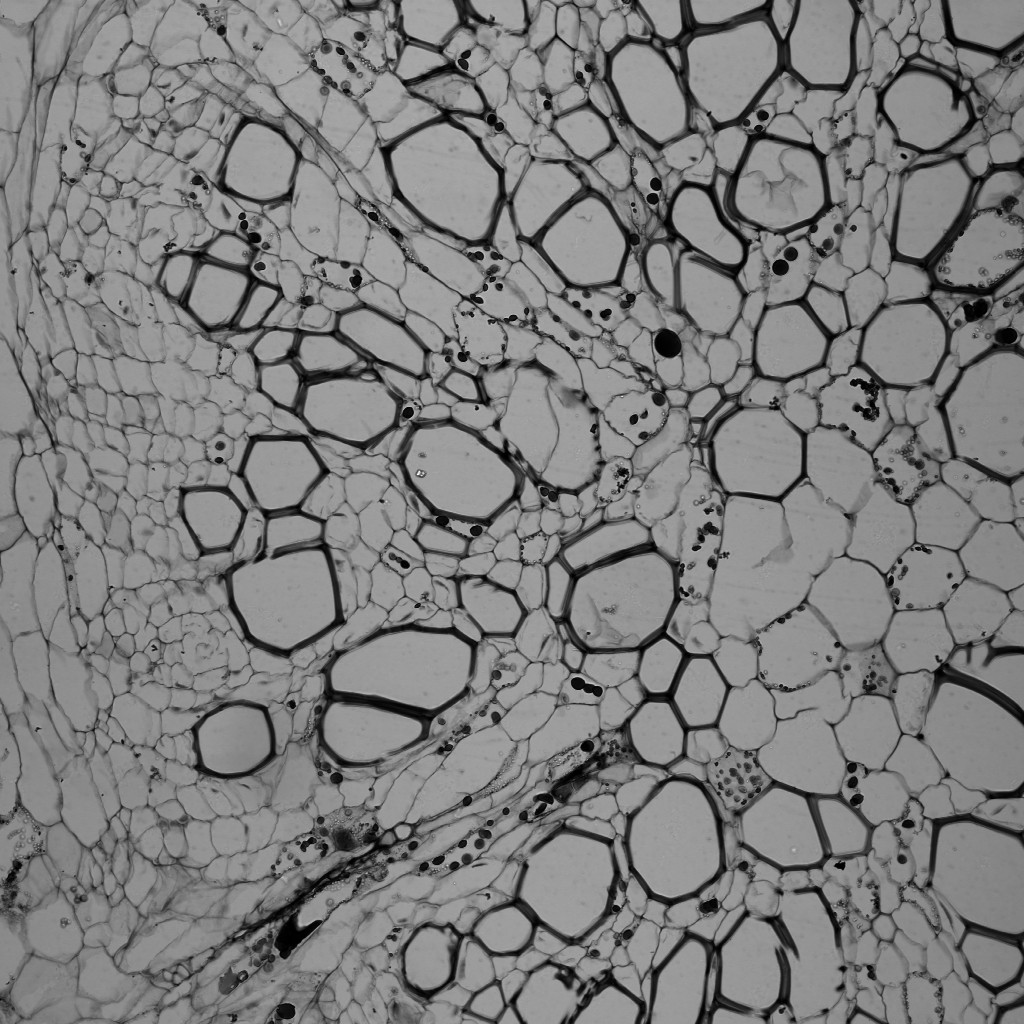
顕微鏡の電動ステージを精密制御して観察位置を変えてゆき、自動でつなぎ合わせる(タイリング)ことも可能です。組織標本など1つの視野に収まりきらないようなサンプルでも、簡単にサンプル全域の共焦点画像を取得することができます。以下の画像では、透過像でわずかに端に光のムラが発生しておりますが、”視野のずれや継ぎ目”は皆無であり、広域にわたって共焦点画像の取得が可能であることが確認できると思います。
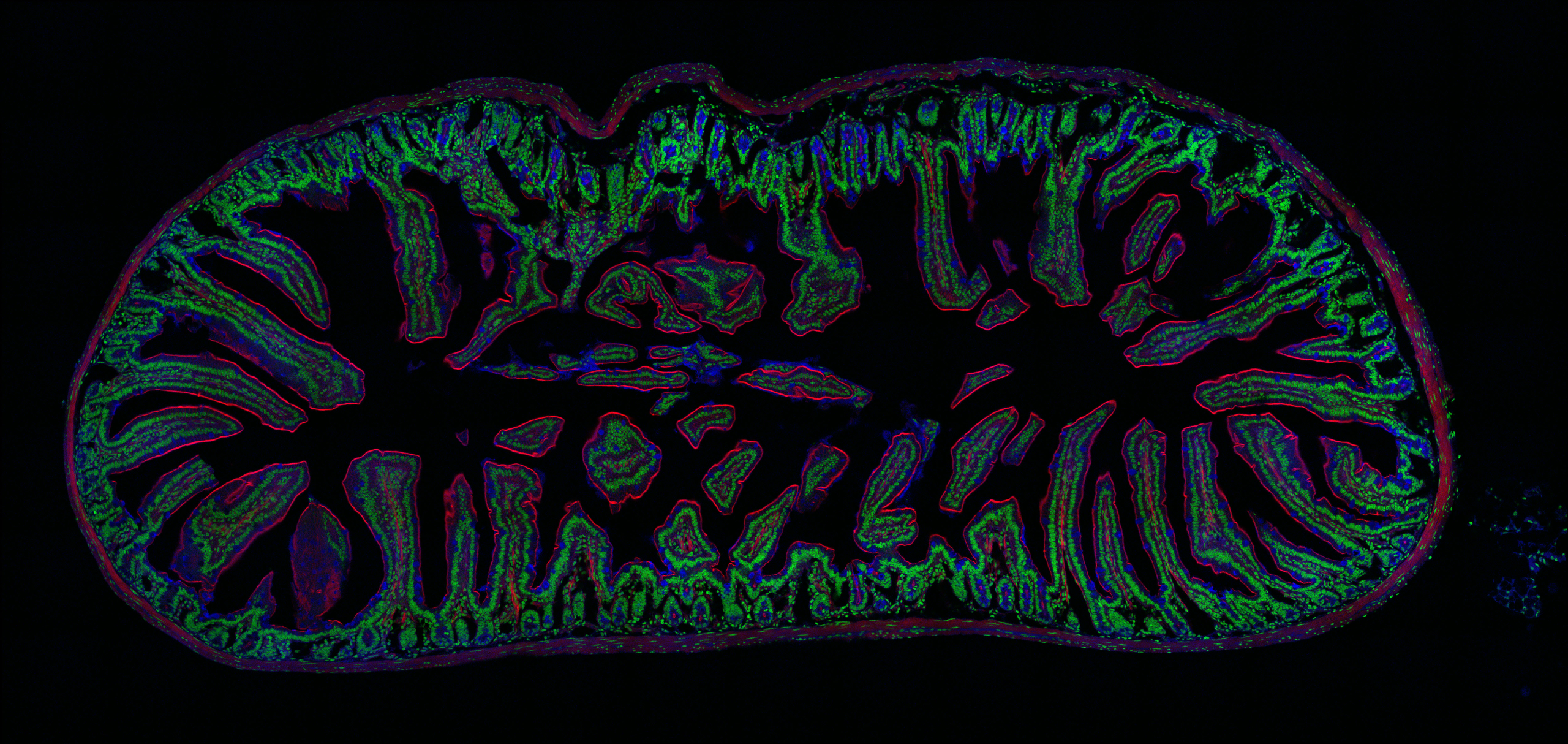
60倍油浸レンズで1024×1024の解像度の画像を取得し、それを縦:7×横:15=105枚の画像をつなぎ合わせました。超高解像度のためオリジナルファイルは300MB以上となり、JPEG形式でもサイズがあまりにも大きいため、ズームアップしても鮮明に観えているデーターを示せないことが残念です…。

これは縦:3mm, 横:4mmほどになり、このようにディッシュやスライドガラスのかなり広範囲を網羅した観察もできます。




※上記の「ムクゲの茎サンプル」と「シイタケの菌褶(シイタケ断面)サンプル」は、株式会社ヤガミの「植物組織プレパラート」になります。
透明な試料の透過像観察
意外と忘れられがちですが、共焦点顕微鏡でも、広義の透過像(明視野像・位相差像・微分干渉像)を観察することができます。
もちろん蛍光画像の観察が主であることが多いですが、以下のように、鮮明で優れた画像を観ることができます。特にレーザー走査型の共焦点顕微鏡の特長として、「ズームをかけることができる」という点が挙げられますため、小さいサンプルをズームアップした透過像も取得可能です。
「透過像を見るためだけで、共焦点顕微鏡を使いたい」という依頼でも、もちろん応えられますので、いつでもご相談ください。

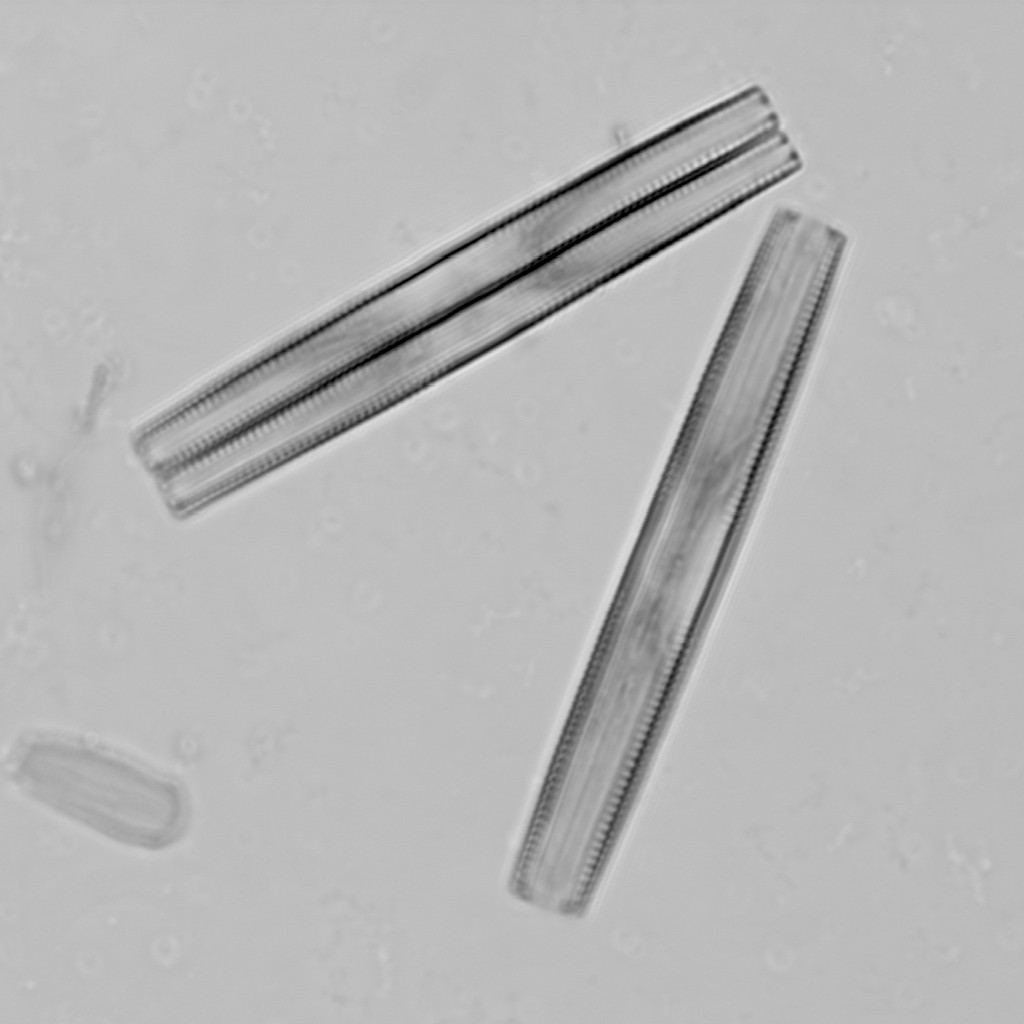
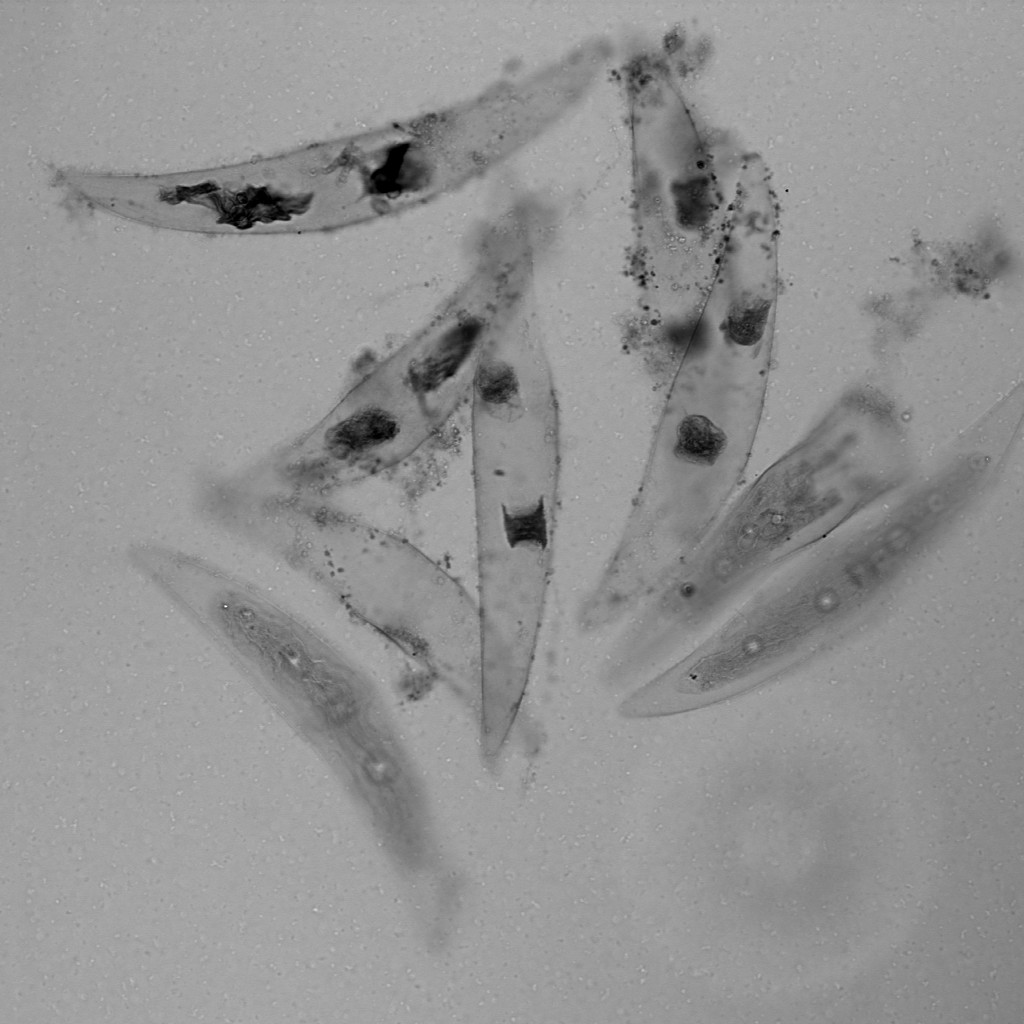
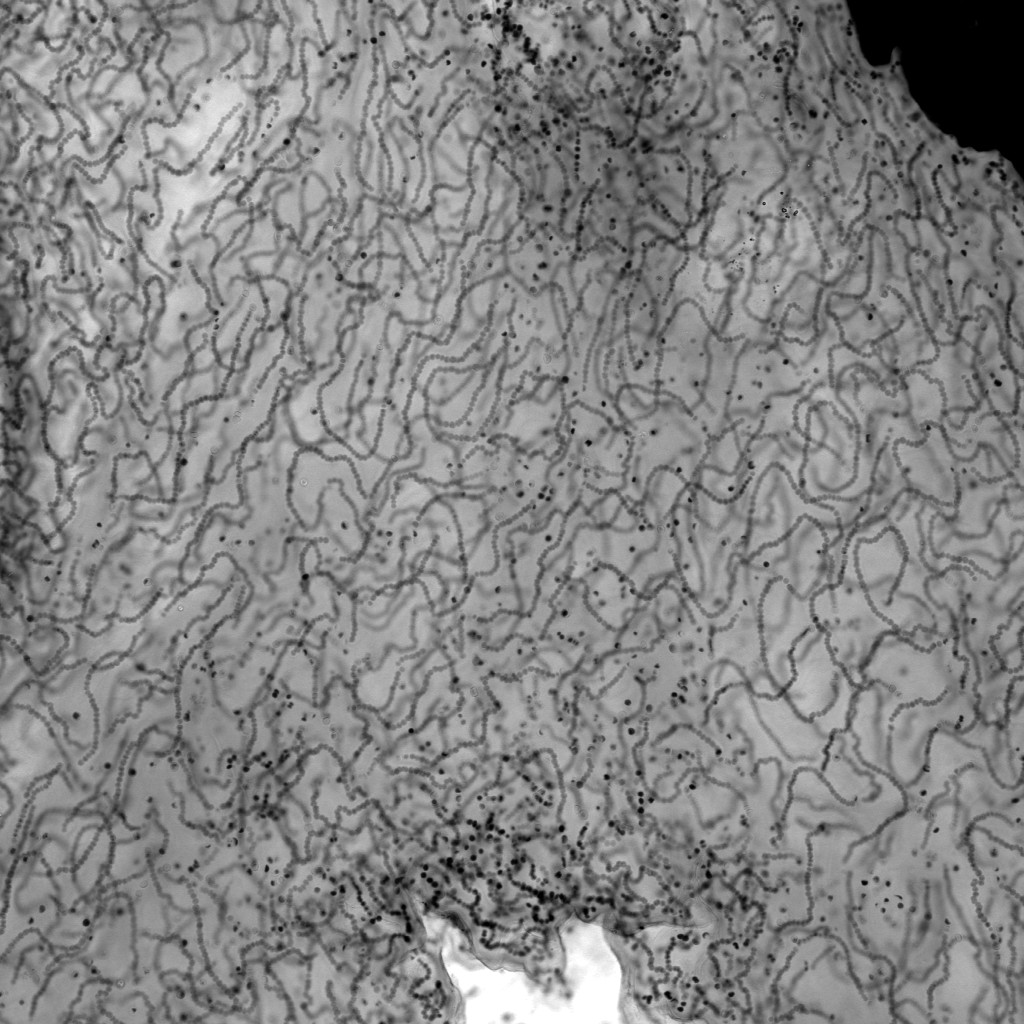
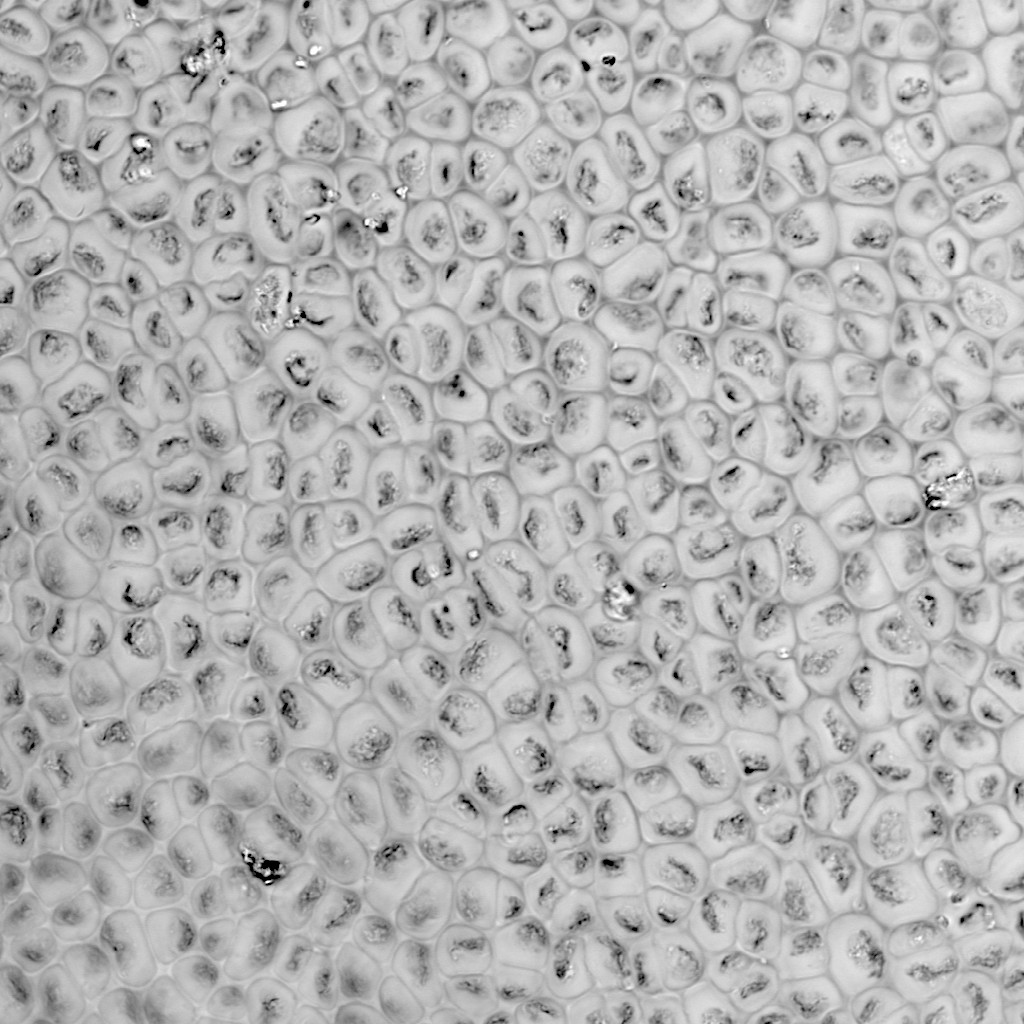

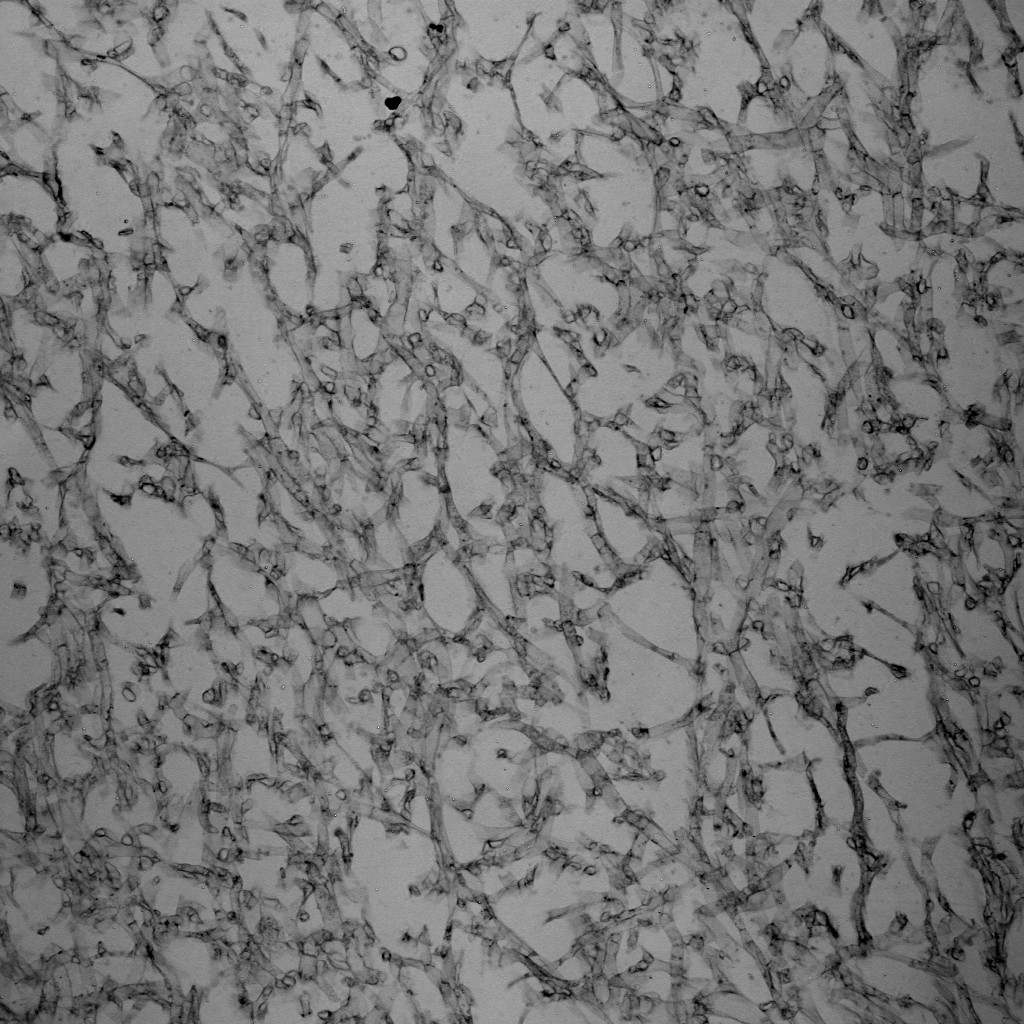
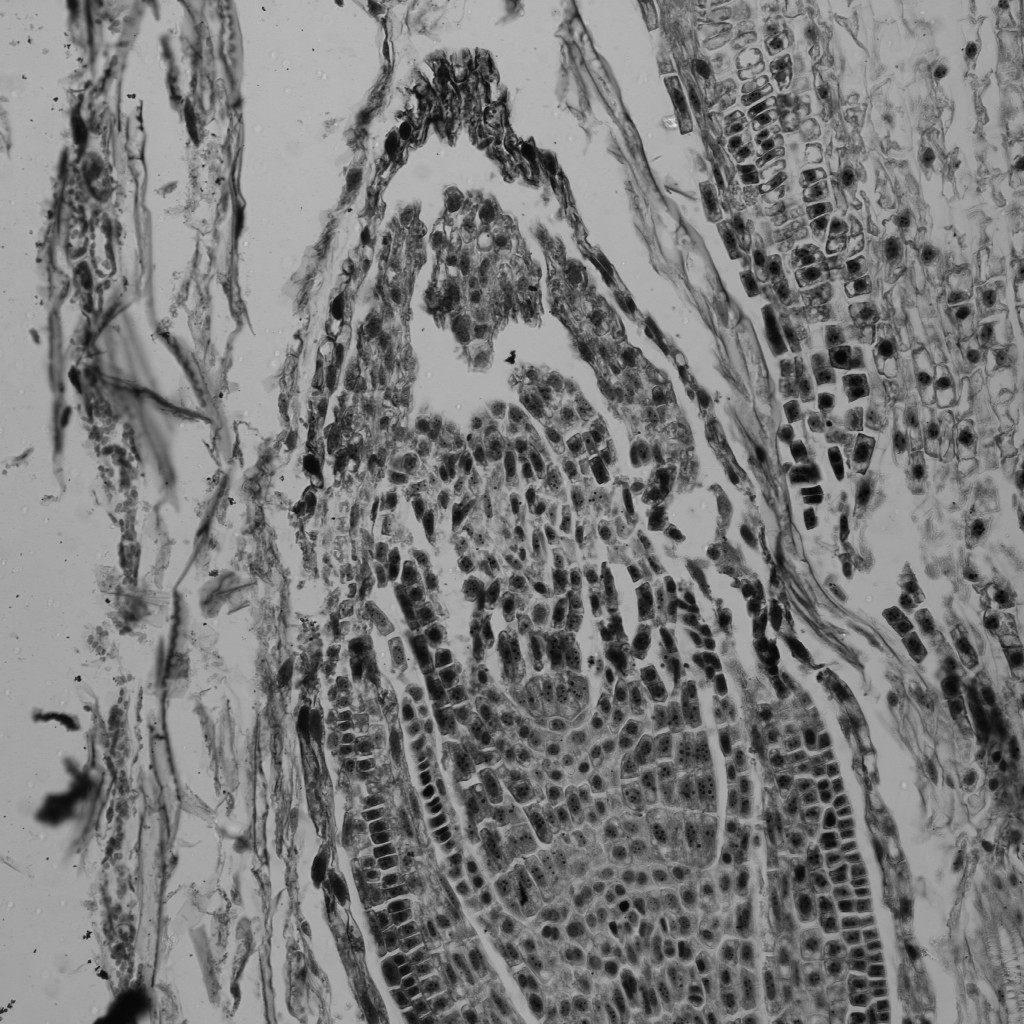



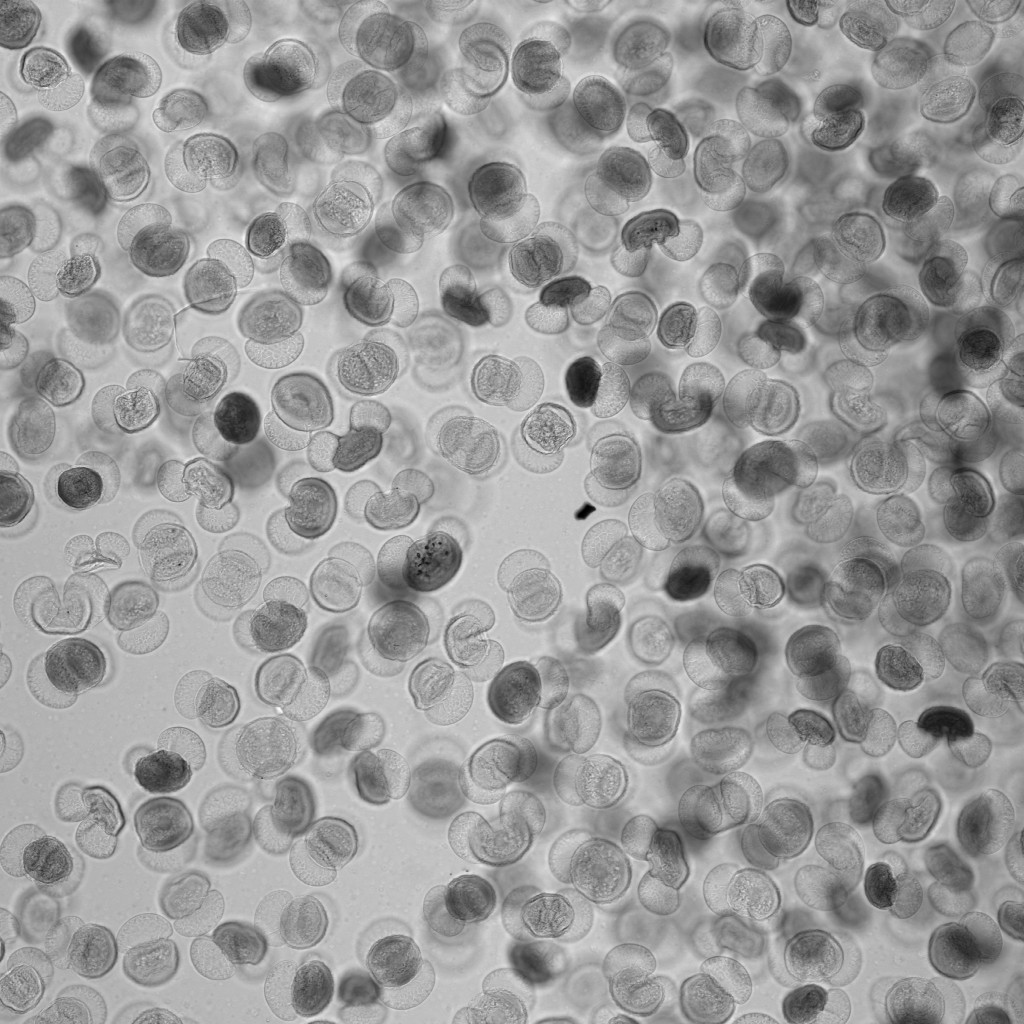
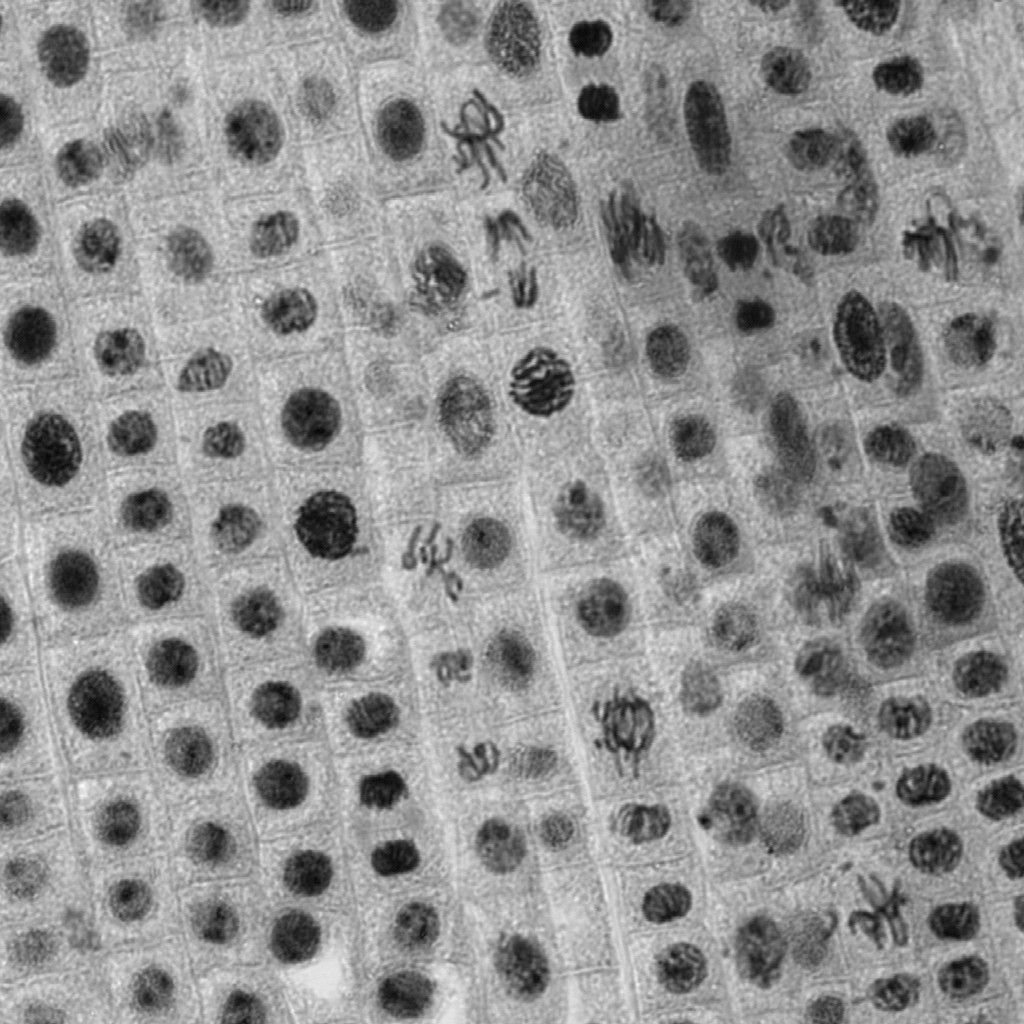

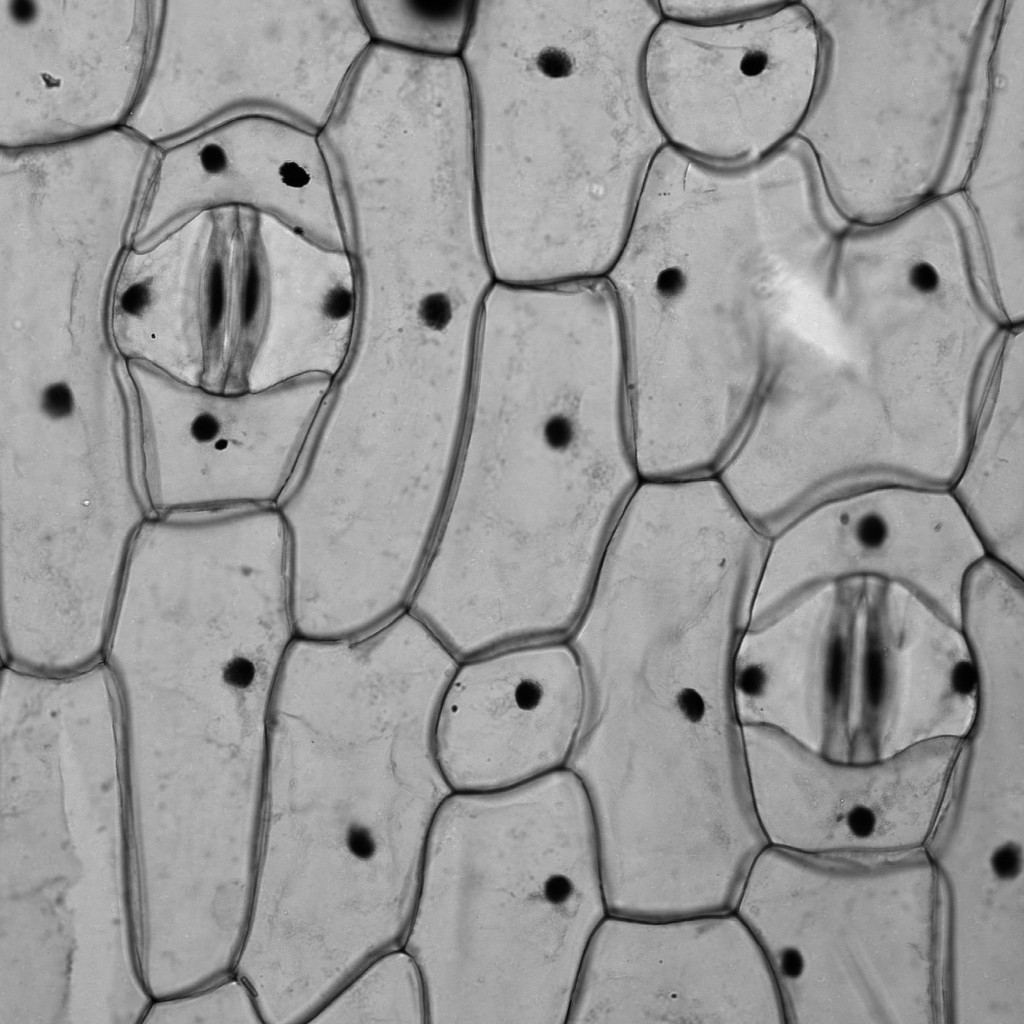
※ この植物サンプルは、京都科学の「植物組織プレパラート(40種)」と、株式会社ヤガミの「植物組織プレパラート」になります。
不透明な試料の反射像観察
更に応用的な観察方法として、励起レーザーと搭載のミラー、そして観察波長をうまく制御することで、「透過像の観察ができない不透明の基板」などであっても、反射像を取得することも可能です。更に共焦点顕微鏡の特性を活用することで、任意のサイズにズームをかけたり、反射像と蛍光像の同時取得もできます。

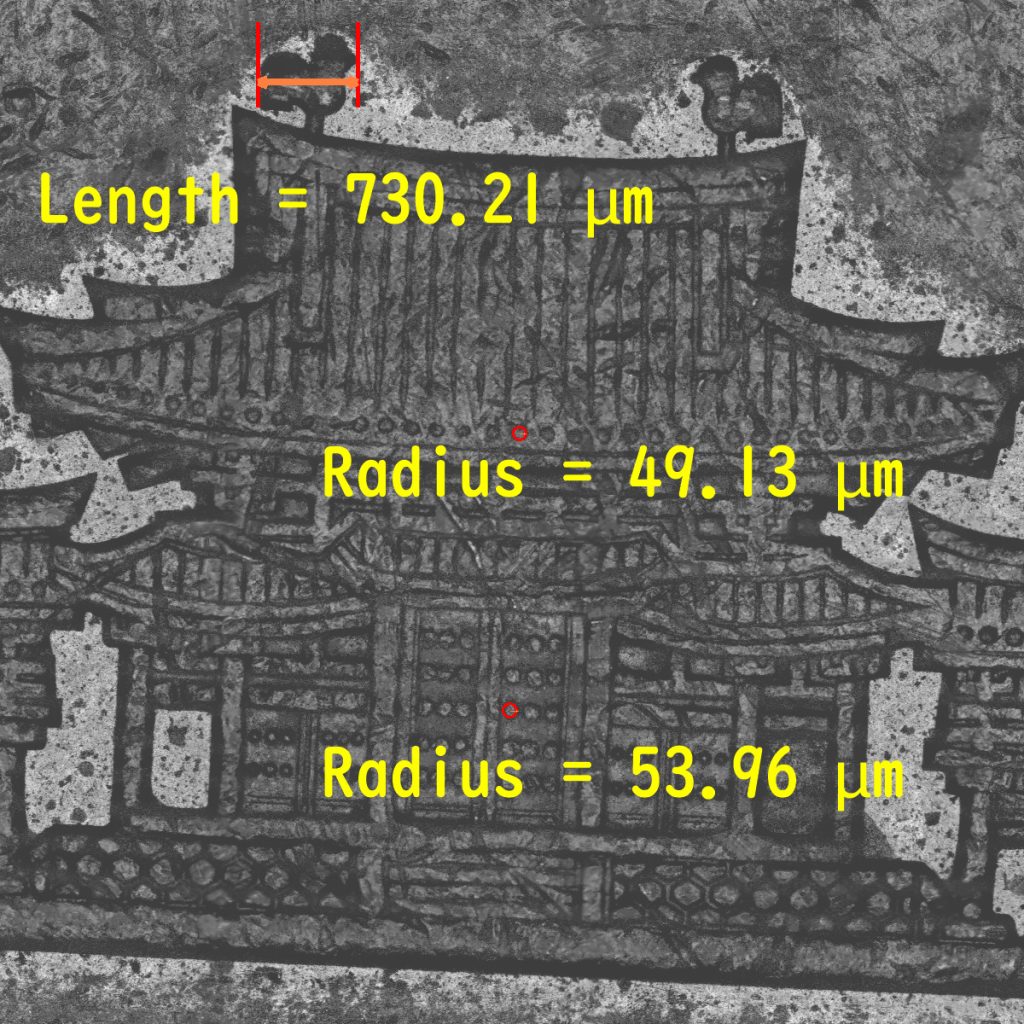
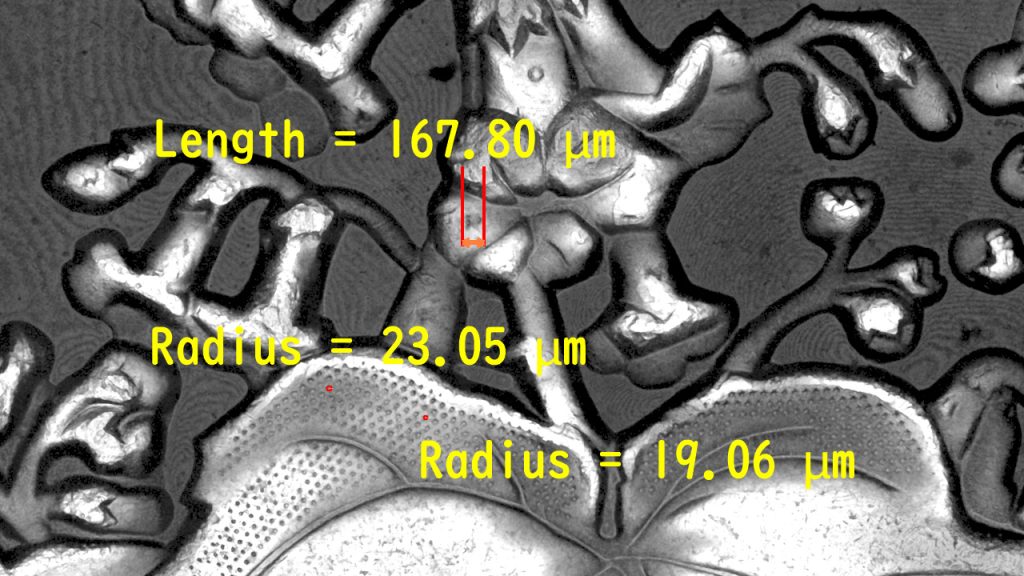
左側がつなぎ合わせた硬貨全体、右側が一部(視野の2倍程度)で、反射像でも継ぎ目なく広域が観察できます。肉眼では観ることが難しい、平等院鳳凰堂の屋根の上の鳳凰(約700マイクロメートル)や、扉などの円い構造(約50マイクロメートル)も、はっきりと反射像で観られることがわかるかと思います。

一般の共焦点観察同様に、Z位置を変えながら反射像を取得する、「XYZ観察」を行いますと、単なる透過像の様相とは異なり、各Z位置でフォーカスの合う様子が観察できます。メーカーにも確認したところ、反射像の取得においても、光学的にはピンホールを通過するため、光学断面像を取得していると考えてよく、像の厚さはピンホールの大きさに依存するため、反射像の厚さ=ソフトウエアで表示される光学切片の厚さと考えてよいと思われる」と返事をいただきました。
つまり、「非蛍光性サンプルでも、反射像から3次元像の取得が可能」となります。
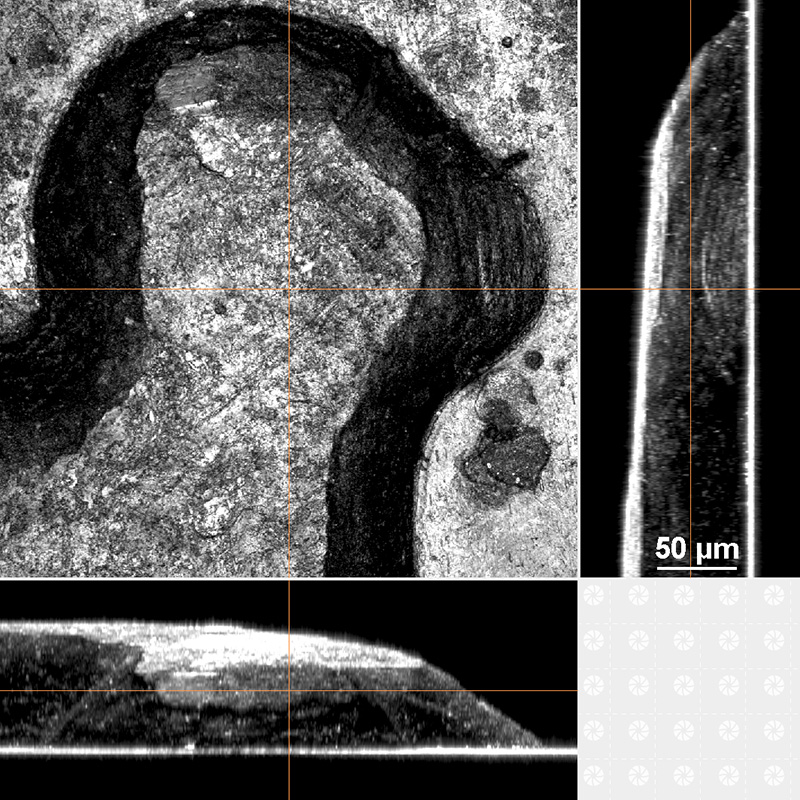
10円硬貨の「平等院鳳凰堂の屋根の鳳凰」でXYZ観察を行い、こちらから反射像による断面図を作成してみました。数十マイクロメートルの厚さと考えられます。
摩耗のない新品の硬貨ですと、もう少し厚みや断面図の様子が異なっているかもしれません。
高感度観察=低ダメージでの観察(Station-4)
2019年6月に当センターに移管となったStation-4は、ニコンA1の第5世代にあたるモデルとなっており、第1世代(もしかしたら第0世代に近い?)のStation-1からは、格段に進化した機種です。長所の1つとして、高感度の検出系(GaAsPタイプ)が搭載されており、従来よりも蛍光シグナルが暗いサンプルでも検出可能となり、換言すると弱いレーザーパワーでも、十分な輝度での検出が可能です。
このため、褪色や光ダメージの懸念から困難かと思われていた、共焦点顕微鏡での短いインターバルでのタイムラプス観察なども、対応できる可能性が大きいですので、ぜひお試しください。
三重蛍光染色を行ったHeLa細胞を、10秒間隔で1時間にわたって観察。左側はStation-1で、右側は新型のStation-4で観察。
同程度の検出蛍光輝度としながら、かなりレーザーの強さを落としているため、ほとんど光褪色は生じませんでした(観察前は、「Station-1は、直ちに褪色するため、その様子を比較しよう」と思っていたので、予想外です…)。ただStation-1での観察画像は、細胞が少しずつ弱って縮んでいく様子が、一方でStation-4で取得した画像は、良好な状態が維持されている様子がうかがます。
1K解像度で、高速観察をしてみよう!(Station-4)
前述の[A1での高速画像取得]でも記しましたように、A1には高速観察用のスキャナも搭載されており、毎秒数枚といった画像取得も可能となっております。
更にStation-4では、解像度: 1024でも高速画像取得が可能となりましたうえ、高感度の検出系が搭載されましたため、高速でも十分明るい高解像度画像取得ができるようになりました。こちらですと、最速で毎秒420枚 (512×32ピクセル) / 33枚 (512×512ピクセル) / 15枚 (1024×1024ピクセル)という超高速画像取得も可能ですので、超高速で発生する生物現象の可視化にも対応できると思われます。
HeLa細胞のミトコンドリアをMitoTracker-Greenで蛍光染色し、高速取得モードにより、XY解像度:1024ピクセル; 毎秒7.5枚・5分間連続取り込みによって観察(毎秒15枚取得した画像2枚から、平均化処理を行う)。
※オリジナル画像は、7.5 x 300→2250枚と数が多いわりに画像間の変化は小さく、ここではオンライン閲覧の関係上、15枚間隔=2秒ごととし、更に大幅に解像度も下げた動画を用意したことは、ご了承ください。
超高速で高解像度の画像が取得できるため、個々のミトコンドリアの動きも鮮明に把握できます。また弱いレーザーパワーでも十分に明瞭な画像が取得できるため、5分間レーザーを当て続けても、あまり光褪色が生じていないことも確認できます(ムービーが最後から最初に戻る際に、確認してください)。